
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Учебное пособие: Диеновые углеводороды
Учебное пособие: Диеновые углеводороды
Диеновые углеводороды (алкадиены или диолефины)
План:
1). Номенклатура и изомерия. Классификация.
2). Способы получения.
3). Химические свойства.
4). Отдельные представители. Каучуки.
5). Применение каучуков в строительстве.
I. Номенклатура и изомерия. Классификация
Непредельные соединения, содержащие в молекуле две двойные связи, называют диеновыми углеводородами. Их называют также алкадиенами или диолефинами.
Общая формула таких соединений СnH2n-2.
По систематической номенклатуре диеновые углеводороды называют также как этиленовые, заменяя суффикс –ен на –диен (две двойные связи). Положение каждой двойной связи обозначается цифрой. Нумерологию производят так, чтобы эти цифры имели меньший порядковый номер:
Довольно часто применяют рациональные и тривиальные названия (дивинил, изопрен и т.д.). Свойства диеновых углеводородов определяются их строением и, в первую очередь, взаимным расположением двух двойных связей в молекуле. Если эти связи расположены рядом, то они называются кумулированными или алленовыми: СН2=С=СН2 (пропадиен (аллен)). Две двойные связи могут быть разделены одной простой связью. Такие связи называют сопряженными или конъюктивированными: СН2=СН-СН=СН2 (бутадиен-1,3 (дивинил)). Диены, в молекулах которых двойные связи разделены двумя или несколькими простыми связями, называют диенам с изолированными или несопряженными связями:
СН2=СН-СН2-СН2-СН2-СН=СН2 (гептадиен – 1,6).
Из этих трех видов диеновых углеводородов наибольшее значение имеют диены с сопряженными двойными связями. Они способны полимеризоваться и образовывать цепные полимерные материалы.
II. Способы получения
Рассмотрим некоторые способы получения наиболее важных представителей диеновых углеводородов – производных алкадиенов – 1,3.
1. Дивинил и изопрен могут быть выделены из продуктов пиролиза нефти.
Пиролиз: парофазный крекинг при более высоких температурах (650-9000С) и атмосферном давлении.
Термический крекинг: жидкофазный процесс, переработка тяжелых фракций и остатков от переработки нефти, а также легких фракций - керосина, газойля при 470-5400С и давлении 3,9-5,9 МПа; и парофазный процесс, переработка гудрона, битумов и крекинг-остатков при 550-6000С и нормальном давлении.
2. Основной промышленный способ получения бутадиена – 1,3 (дивинила) состоит в дегидрировании н-бутана или н-бутилена над хромо-алюминиевым катализатором (оксид хрома на оксиде алюминия)
Дегидрированием изопентана или изоалленов (пентан-пентеновой фракции газов крекинга нефти) получают изопрен:
Процесс получения изопрена сложнее чем получение бутадиена-1,3, так как в условиях дегидрирования могут получаться разные изомеры.
3. Дивинил и изопрен получают также дегидратацией гликолей:
4. Впервые в нашей стране дивинил был получен методом каталитического превращения этилового спирта по Лебедеву (1931г). Этот метод был затем положен в основу промышленного синтеза дивинила. Процесс протекает с применением дегидратирующе-дегидрирующих катализаторов (Al2O3 – ZnO) при 4500С:
Однако в настоящее время этот метод уже не находит широкого применения.
5. Изопрен можно получать из ацетона и ацетилена по методу А.Е. Фаворского:
III. Химические свойства
1. Реакции присоединения.
Диены, соединение несопряженные двойные связи, ведут себя как обычные алкены. Присоединение идет независимо к каждой из этих связей.
При этом, может затрачиваться две молекулы реагента (галогена, галогеноводорода и др.):
![]() СH2=CH–CH2–CH2–CH–CH2 +
2HBr CH2Br–CHBr–CH2–CH2–CHBr–CH2Br
СH2=CH–CH2–CH2–CH–CH2 +
2HBr CH2Br–CHBr–CH2–CH2–CHBr–CH2Br
1,2,5,6 тетрабромгексан
В то же время диеновые углеводороды с сопряженными двойными связями обладают своеобразными свойствами. Они присоединяют реагент не только по одной или двум отдельным двойным связям (1,2 – присоединение), но и к противоположным концам молекулы (1,4 – присоединение).
Выход продуктов 1,4 – или 1,2 - присоединения определяются характером реагента и условиями проведения реакции. Например, присоединение бромоводорода в присутствии пероксидных соединений идет в 1,4 – положения, а в отсутствие – в положение 1,2.
Гипогалогенные кислоты присоединяются к диенам преимущественно в 1,2 – положение:
![]() CH2=CH-CH=CH2 + HOBr CH2Br-CHOH-CH=CH2
CH2=CH-CH=CH2 + HOBr CH2Br-CHOH-CH=CH2
1-бромбутен-3-ол-2
Присоединение галогеноводородов:
![]() CH2=CH-CH=CH2 +
HBr CH2Н-CH=CH=CH2Br
CH2=CH-CH=CH2 +
HBr CH2Н-CH=CH=CH2Br
1-бромбутен-2
Диеновые синтезы: Одной из наиболее важных реакций, применяемых для получения многих циклических органических соединений, является диеновый синтез. Этот вид реакции состоит в 1,4 – присоединении алкена или алкина к диену с сопряженными двойными связями. Такие реакции известны как синтез Дильса-Альдера. Простейшим примером диенового синтеза служит реакция присоединения этилена к бутадиену:
Молекула бутадиена - 1,3, представляющая собой сопряженную систему π-электронов, нет «чистых» двойных и одинарных связей, а наблюдается довольно равномерное распределение π - электронной плотности по всей молекуле с образованием единой молекулярной орбитали. Система …-СН=СН-СН=СН-. -. ведет себя не как сумма изолированных двойных связей, а как единое целое эффективно передающее взаимное влияние атомов. Схематично это выглядит следующим образом:
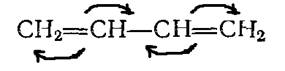 или
или
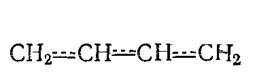
Взаимодействие двух или нескольких соседних пи-связей с образованием единого облака π-енов, в результате чего может легко происходить передача взаимовлияния атомов этой системы, называющейся эффектом сопряжения. Этот эффект способствует понижению общей энергии молекулы. Поэтому диены с сопряженными двойными связями довольно устойчивые силы. Если же диен вступает во взаимодействие с реагентом, то под его влиянием происходит перераспределение электронной плотности в молекуле (динамический эффект сопряжения).
2. Реакции полимеризации – эти реакции имеют особое значение, так как приводят к образованию каучукоподобных материалов – эластомеров. Причиной таких свойств полимеров является присутствие в полимерной молекуле двойных связей, которых нет в полимерах, полученных из алкенов. Полимеры, напоминающие по свойствам каучук, образуются при полимеризации 1,3 – бутадиена.
IV. Отдельные представители. Каучуки
Дивинил (бутадиен - 1,3)
![]()
Бесцветный газ с характерным неприятным запахом, сжигающийся при температуре - 50С. Является одним из важнейших мономеров для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Изопрен (2-метилбутадиен-1,3)
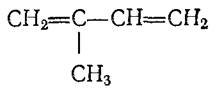
Бесцветная жидкость с температурой кипения =340С. Является основной структурной единицей природного (натурального) каучука и других соединений. Служит мономером для получения синтетического каучука.
Хлоропрен (2-хлорбутадиен-1,3)
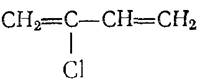
Бесцветная токсичная жидкость, кипящая при температуре 59,40С. Применяют в производстве хлоропренового каучука, клеев.
2,3-диметилбутадиен-1,3
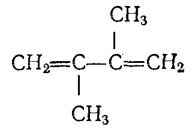
Жидкость, кипящая при температуре 69,60С. Легко полимеризуется с образованием так называемого метилкаучука. При полимеризации этих диенов образуются различные каучуки.
Каучук высокомолекулярное соединение, имеет огромное техническое значение, служит основой для производства разнообразных резиновых изделий. Делится на два класса: натуральные каучуки и синтетические.
Натуральный каучук – природный непредельный полимер (С5Н8) n с молекулярной массой от 15000 до 500000, содержащийся в млечном соке некоторых тропических деревьев (гевеи бразильской и др.) и растениях (кос-сагыз, тау-сагыз, гваюла). Млечный сок (латекс), полученный подсечкой каучуконосных деревьев, коагулируют различными способами (например, действием кислот и т.д.)
Было установлено, что структурной единицей натурального каучука является изопреновая группа:
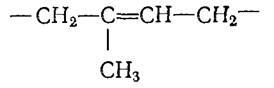
Соединения, связанные между собой в 1,4-положение, такие группы образуют макромолекулу каучука, и имеют цис-строение:
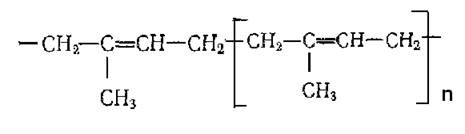
Натуральные каучуки обладают высокой эластичностью. Он растворяется в алифатических и ароматических углеводородах, образуя вязкие растворы. Подобно диеновым углеводородам, каучук склонен к реакциям присоединения (например, с бромом, HBr и др.). Разновидностью каучука является гутаперча (менее эластичная), имеющая транс-1,4-строение.
Синтетические каучуки – аналоги натурального каучука, полученные синтетическим путем из мономеров (каучукогенов) – бутадиена-1,3, изопрена, хлоропрена и др. Основной метод их получения – цепная полимеризация.
Для улучшения свойств каучука полимеризацию каучукогенов проводят совместно с другими непредельными мономерами (стиролом, акрилонитрилом, изобутиленом и др.).
Основные типы синтетических каучуков.
Бутадиеновые каучуки – наиболее распространенный тип СК. Их получают полимеризацией бутадиена-1,3 (дивинила). Они обладают высокой износо - и морозостойкостью. Находят применение для изготовления уплотнителей и герметизирующих составов при крупнопанельном строительстве.
Изопреновый каучук – применяют в производстве шин, резинотехнических изделий, для изоляции кабелей и др.
Будатиен стирольный каучук – при содержании 40-50% связанного стирола каучук используют для изготовления плиток, для полов.
Бутадиен нитрильный каучук - получают совместной полимеризацией бутадиена-1,3 и акрилонитрила H2C=CH-CN. Его отличают высокое масло - и бензостойкость. Устойчив к нагреванию и износу. В виде латекса применяется в производстве бумаги и нетканых текстильных изделий.
Хлоропреновый каучук (наирит, неопрен) – получают полимеризацией хлоропрена:
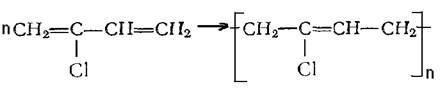
Также применяется в производстве резинотехнических изделий, клеев, для изоляции проводов и кабелей. Особый интерес представляют фторкаучуки, обладающие высокой масло - и термостойкостью, а также стойкостью к химическим реагентам. Их получают из фторированных алкенов или их производных (например, трифторхлорэтилена, винилиденфторида и др.).
Особенно высокой термической устойчивостью и рядом других особенностей отличаются кремнийорганические (силиконовые) каучуки. Обладают высокой свето-, озоно - и теплостойкостью. Устойчивы к различным маслам и нефтепродуктам, ко многим органическим растворителям. Отличаются высокой износостойкостью и негорючестью. Применяют в качестве изоляции проводов и кабелей, обкладки химической аппаратуры и валов. Служат в производстве резинотехнических изделий и клеев.
В связи с высокой пластичностью, термической неустойчивостью натуральные и синтетические каучуки нельзя использовать непосредственно. Для придания каучукам прочностных свойств, эластичности и термостойкости их подвергают обработке серой или ее соединениями (например, S2Cl2 хлорид серы) – вулканизируют. Этот процесс заключается в образовании новых поперечных (мостиковых) связей между полимерными цепями. В результате такой обработки каучук превращается в технический продукт – резину, которая содержит до 5% серы. Кроме серы в резину входят различные наполнители, пластификаторы, красители, антиоксиданты и др. Вулканизированный каучук, содержащий по массе свыше 30% серы, называется эбонитом.
V. Применение каучуков в строительстве
Особенно широко используется в строительстве резина. Она может входить в элементы строительных конструкций, начиная с фундамента и заканчивая деталями отделки. В строительных конструкциях, которые работают в условиях ударных нагрузок и вибрации, упругость, присущая резине, является важным качеством. Каучук может улучшить и свойства обычного бетона. Если к цементной массе вместо воды добавить суспензию синтетического каучука, то бетон приобретает повышенную водонепроницаемость, устойчивость против масел и агрессивных жидкостей. Кроме того, он не растрескивается при резких колебаниях температуры.
Из резины создано много различных тепло - и звукоизоляционных материалов для полов. Например, широкое распространение получил резиновый линолеум – релин, применяемый в жилищном строительстве. Релин применяется и в виде плиток резиновый паркет. Каучуки часто вводят в асфальт для повышения его износостойкости и безопасности движения на дорогах.
При крупнопанельном строительстве нельзя обойтись без герметиков – материалов, которые изолируют внутренние помещения от «улицы». Главное из свойств эластичность, которое позволяет повторять за панелью (при температурных колебаниях) каждое движение без потери герметизирующих свойств. В качестве таких герметиков используют тиокоп, полиизобутилен и другие каучуковые композиции.
Гибкий, прочный, водостойкий и морозоустойчивый кровельный материал для крыш можно получать из отходов невулканизированной резины и древесных опилок.
ОРГАНИЧЕСКИЕ ГАЛОГЕНИДЫ
План:
Классификация галогенидов
Номенклатура
Методы получения органических галогенидов
Физические свойства
Химические свойства
Применение органических галогенидов
I. Классификация галогенидов
Органические галогениды – это производные углеводородов разных классов, из которых один и более атомов водорода замещен на атомы галогенов. Галогениды делятся прежде всего на группы по типу атома углерода, с которым связан атом галогена.
1. Производные с галогеном при насыщенном атоме углерода:
Алкилгалогениды СН3Сl, Br-CH2-CH2-Br
Циклоалкилгалогениды
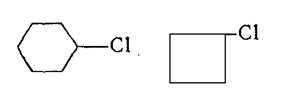
Соединения с атомом галогена в α-положении к кратной связи алкилгалогениды – CH2=CH-CH2X, пропаргилгалогениды. . HC=C-CH2X и бензилгалогениды Ar-CH2X
2. Галогенпроизводные с галогеном при ненасыщенном атоме углерода C(sp2, sp)
Алкенил-, алкинилгалогениды с галогеном у кратной связи CH2=CHX, HC=CX.
Арилгалогениды с галогеном в ароматическом ядре.
По характеру галогена различают фториды, хлориды, бромиды, йодиды (например CH3F, CH3Cl, CH3Br, CH3J)
По числу галогенов: моно-, ди-, три - и полигалогенпроизводные (например CH3Cl, Br-CH2-CH2-Br)
По положению галогена в углеродном скелете в зависимости от характера атома углерода, с которым связан галоген, алкилгалогениды делятся на
II. Номенклатура
1. Тривиальная
СH3Br бромоформ; СН3J – йодоформ; Н2С=ССl-СН-СН=СН2 - хлоропрен
2. Рациональная – название по углеводородному радикалу, с которым связан галоген (по типу неорганических солей)
NaCl – хлорид натрия
CH3CH2Cl этилхлорид (хлористый этил)
CH2=CH-Cl винилхлорид (хлористый винил)
CH2=Cl2 метиленхлорид
C6H5CH2Cl бензилхлорид (хлористый бензил)
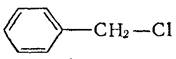
C6H5CH=Cl2 бензилиденхлорид
3. По номенклатуре ИЮПАК нумеруют углеводород и к его названию прибавляют название галогена с указанием его положения
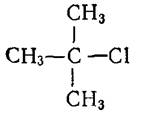
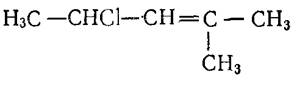
2-хлор-2-метилпропан 2-метил-4-хлор-2-пентен
Порядок нумерации определяет кратная связь. Галоген и алкилы при нумерации равны по значимости.
III. Методы получения
IV.Физические свойства
Галогенпроизводные углеводороды являются бесцветными газами или жидкостями со своеобразным запахом, в воде практически нерастворимы и в большинстве случаев тяжелее ее. При введении в молекулу углеводорода атомов галогена вместе с увеличением молекулярного веса увеличиваются температура кипения и температура плавления, плотность. При переходе к полигалогенидам, снижаются горючесть, воспламеняемость органических галогенидов. Например, CCl4 применяется для тушения пожаров.
V. Химические свойства
VI. Применение органических галогенидов
Отметим важнейшие области использования органических галогенидов:
1. Растворители – все жидкие галогениды и дигалогениды (CHCl3, CCl4, дихлорэтан, хлорбензол и др.)
2. Органический синтез
© 2009 База Рефератов