
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Производство азотных удобрений
Реферат: Производство азотных удобрений
ПРОИЗВОДСТВО АЗОТНЫХ УДОБРЕНИЙ
1 Общая характеристика
Азотные удобрения могут содержать азот в форме свободного аммиака и аминов (аммиакаты), ионов NH4+ и NO3-, аминогруппы NH2, а также в их сочетании. В соответствии с этим различают следующие виды азотных удобрений: аммиачные, аммонийные, нитратные, амидные и аммонийно-нитратные.
Все азотные удобрения водорастворимы, азот из них хорошо усваивается растенимями, особенно из аниона NO3-, который отличается высокой подвижностью в почве. По агрегатному состоянию азотные удобрения делятся на твердые (соли и карбамид) и жидкие (аммиак, аммиачная вода и аммиакаты, представляющие собой растворы твердых удобрений). В табл. 1.1 приведены характеристики важнейших азотных удобрений и удельный вес их в общем балансе производства.
Таблица 1.1 - Ассортимент и характеристика азотных удобрений
| Удобрение | Формула действующего вещества | Содержание азота, % | Удельный вес, %, по годам | |
| 1960 | 1980 | |||
|
Аммиачные Аммиак жидкий Аммиачная вода |
NH3 NH3 |
82 16,1 – 20,1 |
2,8 | 7,1 |
|
Аммонийные Сульфат аммония |
(NH4)2SO4 |
19,9 – 21,0 | 17,9 | 1,1 |
|
Нитратные Нитрат натрия Нитрат кальция |
NaNO3 Ca(NO3)2 |
11,0 – 16,0 18,0 – 11,0 |
- - |
- - |
|
Амидные Карбамид |
CO(NH2)2 |
46,0 – 46,1 | 2,1 | 27,1 |
| Аммонийно-нитратные |
NH4NO3 |
32,1 – 31,0 | 73,3 | 40,1 |
|
Карбамидоформ-альдегидные Карбаминоформ |
NH2CONHCH2 |
33,0 – 42,0 | - | - |
|
Аммиакаты Азотная часть комплексных минеральных удобрений |
- - |
20,0 – 30,0 - |
- - |
- 19,3 |
В приведенных данных прослеживается тенденция снижения производства сульфата и нитрата аммония и увеличения производства карбамида, жидких азотных удобрений и минеральных удобрений, содержащих, наряду с другими элементами, азот (комплексных минеральных удобрений).
Ниже рассматривается технология производства наиболее распространенных азотных удобрений – нитрата аммония и карбамида, на долю которых приходится свыше 60% общего выпуска азотных удобрений.
1.2 Производство нитрата аммония
1.2.1 Свойства нитрата аммония
Нитрат аммония (аммонийная селитра) NH4NO3 – кристаллическое вещество с температурой плавления 169,6ºС, хорошо растворимое в воде. Растворимость при 20ºС равна 0,621 мас. долей, при 160ºС – 0,992 мас. долей. Нитрат аммония сильно гигроскопичен и легко поглощает влагу из атмосферы, в зависимости от температуры может существовать в пяти кристаллических модификациях, различающихся плотностью и структурой кристаллов. Вследствие высокой растворимости в воде, гигроскопичности и полиморфных превращений, сопровождающихся выделением тепла, нитрат аммония легко слеживается. Для уменьшения слеживаемости, которая затрудняет использование продукта, в промышленности используют следующие меры:
- перед складированием полученный продукт охлаждают до температуры ниже 32ºС, так как именно в интервале от 32,3ºС до -17ºС нитрат аммония находится в стабильной ромбической модификации;
- выпускают товарный продукт в гранулированном виде, обрабатывая поверхность гранул ПАВ, образующими на них гидрофобную пленку;
- вводят в состав продукта кондиционирующие добавки в виде нитрата магния и других солей, которые связывают свободную воду и препятствуют переходу одной модификации в другую.
Нитрат аммония в твердом состоянии или в виде высококонцентрированного раствора (плава) при нагревании выше 180 - 200 ºС разлагается:
NH4NO3 = N2O + 2H2O – DH, где DH = 36,8 кДж.
При быстром нагревании в замкнутом пространстве до 400 - 100ºС или инициировании нитрат аммония разлагается со взрывом по уравнению
NH4NO3 = N2 + 2H2O + 0,1O2 – 118 кДж.
Разложение ускоряется в присутствии минеральных кислот и органических веществ. На этом основано использование нитрата аммония в качестве компонента аммонийно-селитровых взрывчатых веществ – аммонитов (смеси с органическими веществами), аммотолов (смеси со взрывчатыми веществами) и аммоналов (смеси, содержащие аллюминий).
Нитрат аммония является безбалластным азотным удобрением и содержит 34,8% азота, из них 17,4% - в аммиачной (NH4+) и 17,4% - в нитратной (NO3-) форме. Поэтому стоимость транспортировки содержащегося в нем азота значительно ниже, чем при перевозке других балластных удобрений (например, сульфата аммония).
1.2.2 Физико-химические основы процесса синтеза
Производство нитрата аммония основано на реакции нейтрализации азотной кислоты газообразным аммиаком с последующим упариванием полученного раствора нитрата аммония.
Нейтрализация. Нейтрализация азотной кислоты аммиаком – это необратимый гетерогенный процесс хемосорбции, протекающий с выделением тепла по уравнению
HNO3 + NH3 = NH4NO3 – DH.
Реакция идет в диффузионной области, и ее скорость лимитируется диффузией аммиака из газа к поверхности жидкости. Количество тепла, выделяющегося при нейтрализации, складывается из теплового эффекта реакции и теплоты растворения образовавшегося нитрата аммония в воде:
Qå = Q1 – (Q2 + Q3),
| где |
Q1 |
– | тепловой эффект реакции нейтрализации 100% азотной кислоты с образованием твердого нитрата аммония; |
|
Q2 |
– | теплота разбавления азотной кислоты; | |
|
Q3 |
– | теплота растворения нитрата аммония. |
Таким образом, тепловой эффект процесса зависит от концентрации азотной кислоты, взятой для нейтрализации.
Подогрев компонентов (азотной кислоты и газообразного аммиака) улучшает перемешивание системы, ускоряет процесс нейтрализации и повышает концентрацию раствора нитрата аммония.
Упаривание раствора нитрата аммония. В результате нейтрализации образуется водный раствор нитрата аммония. При этом за счет теплового эффекта реакции нейтрализации часть воды испаряется в виде сокового пара. Интенсивность испарения зависит от величины теплового эффекта и температуры процесса. Поэтому концентрация образующегося раствора определяется как концентрацией азотной кислоты, так и температурой.
С ростом концентрации азотной кислоты возрастает концентрация образующегося раствора нитрата аммония и увеличивается масса выделяющегося сокового пара.
Для испарения воды и концентрирования раствора нитрата аммония можно использовать как внешнее тепло, подводимое к системе, так и теплоту нейтрализации, выделяющуюся в самом процессе (рис. 1.1.).
![]() Qподв
Qподв
![]()
![]()
![]() H2O(пар) NH4NO3
+ H2O NH4NO3
H2O(пар) NH4NO3
+ H2O NH4NO3
![]() DH реакц
DH реакц
Рисунок 1.1 - Использование тепла при упаривании раствора
Использование теплоты нейтрализации для упаривания раствора позволяет:
- снизить затрату внешнего тепла;
- обеспечить за счет отвода тепла из системы оптимальный температурный режим процесса нейтрализации и избежать опасных перегревов;
- исключить применение сложных охладительных устройств.
При использовании азотной кислоты концентрацией 60 – 61 % и температуре процесса около 70ºС оказывается возможным за счет использования теплоты нейтрализации выпарить основную массу воды, вводимой с азотной кислотой, и получить высококонцентрированный раствор и даже плав нитрата аммония.
В соответствии с принципом использования тепла все существующие варианты технологического процесса производства нитрата аммония делятся на две группы:
1 Без упаривания раствора. Концентрирование раствора осуществляется исключительно за счет теплоты нейтрализации азотной кислоты концентрацией 61%. При этом образуется 96% плав нитрата аммония:
Q = DH; Qподв = 0.
2 С упариванием раствора. Концентрирование раствора осуществляется как за счет частичного использования теплоты нейтрализации, так и за счет подводимого извне тепла:
Q = DH + Qподв.
При этом в зависимости от концентрации азотной кислоты последующее упаривание раствора нитрата аммония может производиться:
- при 18% кислоте в 1-й ступени;
- при 10% кислоте в 2-й ступени.
1.2.3 Технологические системы производства
Технологический процесс производства нитрата аммония состоит из следующих основных стадий: нейтрализации азотной кислоты газообразным аммиаком, выпаривание нитрата аммония, кристаллизации и гранулирования плава, охлаждения, классификации и опудривания готового продукта (рис.1.2.).
В настоящее время в связи с освоением производства 18 – 60% азотной кислоты основная масса нитрата аммония производится на установках АС-67, АС-72, АС-72М, мощностью 1360 и 1171 т/сутки с упариванием в одну ступень, а также на установках безупарочного типа (рис.1.3. и 1.4.)
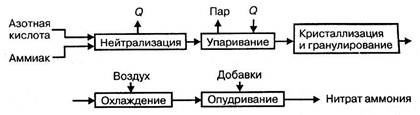
Рисунок 1.2 - Принципиальная схема производства нитрата аммония
Газообразный аммиак из подогревателя 1, обогреваемого конденсатом сокового пара, нагретый до 120 - 160ºС, и азотная кислота из подогревателя 2, обогреваемого соковым паром, при температуре 80 - 90ºС поступают в аппарат ИТН (с использованием теплоты нейтрализации) 3. Для уменьшения потерь аммиака вместе с паром реакцию ведут в избытке кислоты. Раствор нитрата аммония из аппарата ИТН нейтрализуют в донейтрализаторе 4 аммиаком, куда одновременно добавляется кондиционирующая добавка нитрата магния и поступает на упаривание в выпарной аппарат 1. Из него образовавшийся плав нитрата аммония через гидрозатвор-донейтрализатор 6 и сборник плава 7 направляется в напорный бак 8 и из него с помощью виброакустических грануляторов 9 поступает в грануляционную башню 10. В нижнюю часть башни засасывается атмосферный воздух, и подается воздух из аппарата для охлаждения гранул «КС» 12. Образовавшиеся гранулы нитрата аммония из нижней части башни поступают на транспортер 11 и в аппарат кипящего слоя 12 для охлаждения гранул, в который через подогреватель 13 подается сухой воздух. Из аппарата 12 готовый продукт направляется на упаковку. Воздух из верхней части башни 10 поступает в скрубберы 14, орошаемые 20% раствором нитрата аммония, где отмывается от пыли нитрата аммония и выбрасывается в атмосферу. В этих же скрубберах очищаются от непрореагировавшего аммиака и азотной кислоты газы, выходящие из выпарного аппарата и нейтрализатора. Аппарат ИТН, грануляционная башня и комбинированный выпарной аппарат – основные аппараты в технологической схеме АС-72М.
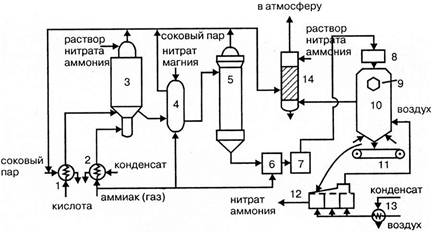
Рисунок 1.3 - Технологическая схема производства АС-72М:
1 – подогреватель аммиака; 2 – подогреватель кислоты; 3 – аппарат ИТН; 4 – донейтрализатор; 1 выпарной аппарат; 6 – гидрозатвор-донейтрализатор; 7 – сборник плава; 8 напорный бак; 9 – виброакустический гранулятор; 10 – грануляционная башня; 11 транспортер; 12 – охладитель гранул «КС»; 13 – подогреватель воздуха; 14 промывной скруббер
Аппарат ИТН имеет общую высоту 10 м и состоит из двух частей: нижней реакционной и верхней сепарационной. В реакционной части находится перфорированный стакан в который подают азотную кислоту и аммиак. При этом за счет хорошей теплоотдачи реакционной массы стенкам стакана, реакция нейтрализации протекает при температуре, более низкой, чем температура кипения кислоты. Образующийся раствор нитрата аммония закипает, и из него испаряется вода. За счет подъемной силы пара парожидкостная эмульсия выбрасывается из верхней части стакана и проходит через кольцевой зазор между корпусом и стаканом, продолжая упариваться. Затем она поступает в верхнюю сепарационную часть, где раствор, проходя ряд тарелок, отмывается от аммиака раствором нитрата аммония и конденсатом сокового пара. Время пребывания реагентов в реакционной зоне не превышает одной секунды, благодаря чему не происходит термического разложения кислоты и нитрата аммония. За счет использования теплоты нейтрализации в аппарате испаряется большая часть воды и образуется 90% раствор нитрата аммония.
Комбинированный выпарной аппарат высотой 16 м состоит из двух частей. В нижней кожухотрубной части диаметром 3м происходит упаривание раствора, проходящего через трубки, обогреваемые сначала перегретым паром, нагретым до 180ºС воздухом. Верхняя часть аппарата служит для очистки выходящей из аппарата паровоздушной смеси и частичного упаривания поступающего в аппарат раствора нитрата аммония. Из выпарного аппарата выходит плав нитрата аммония концентрацией 99,7% с температурой около 180ºС.
Грануляционная башня имеет прямоугольное сечение 11х8 м2 и высоту около 61 м. Через отверстие в нижней части в башню поступает наружный воздух и воздух из охладителя гранул. Поступающий в верхнюю часть башни плав нитрата аммония диспергируется с помощью трех виброакустических грануляторов, в которых струя плава превращается в капли. При падении капель с высоты около 10 м они затвердевают и превращаются в гранулы. Кристаллизация плава с влажностью 0,2% начинается при 167ºС и заканчивается при 140 ºС. Объем воздуха, подаваемого в башне, составляет в зависимости от времени года 300 – 100 м3/час.
В установках АС – 72М применяется магнезиальная добавка против слеживаемости продукта (нитрат магния). Поэтому операции обработки гранул ПАВ, предусмотренной в схемах АС 67 и АС – 72, не требуется.
Принципиальными отличиями технологической схемы производства нитрата аммония безупарочным методом (рис. 1.4.) являются: использование более концентрированной азотной кислоты; проведение процесса нейтрализации при повышенном (0,4МПа) давлении; быстрый контакт нагретых компонентов.
В этих условиях на стадии нейтрализации образуется парожидкостная эмульсия, после разделения которой получают плав концентрацией 98,1%, что позволяет исключить отдельную стадию упаривания раствора.
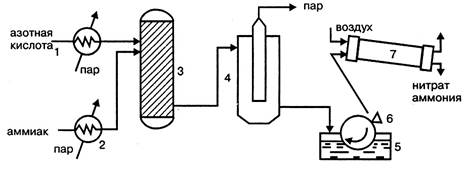
Рисунок 1.4 - Технологическая схема безупарочного метода:
1 – подогреватель азотной кислоты; 2 – подогреватель аммиака; 3 – реактор (нейтрализатор); 4 – сепаратор эмульсии; 1 – барабанный кристаллизатор; 6 – нож; 7 – барабанная сушка.
Нагретые в нагревателях 1 и 2, обогреваемые паром, выходящим из сепаратора, эмульсии 4, азотная кислота и аммиак поступают в нейтрализатор 3, где в результате реакции образуется эмульсия из водного раствора нитрата аммония и водяного пара. Эмульсия разделяется в сепараторе 4 и плав нитрата аммония подается в барабанный кристаллизатор 1, в котором нитрат аммония кристаллизируется на поверхности металлического барабана, охлаждаемого изнутри водой.
Образовавшийся на поверхности барабана слой твердого нитрата аммония толщиной около 1 мм срезается ножом 6 и в виде чешуек поступает для просушивания в барабанную сушилку 7. Подобный продукт в виде чешуек используется для технических целей.
1.3 Производство карбамида
1.3.1 Свойства карбамида
Карбамид (мочевина) диамид угольной, или амид карбаминовой кислот CO(NH2)2. Генетическая связь производных угольной кислоты может быть выражена следующей схемой:
ОН ОН ОNН4 NН2
| | | |
C=О C=О C=О C=О
| | | |
ОН NН2 NН2 NН2
угольная карбаминовая карбамат карбамид
кислота кислота аммония
Карбамид представляет собой твердое кристаллическое вещество с температурой плавления 132,7ºС. Хорошо растворим в воде, этаноле и жидком аммиаке, что используется для получения аммиакатов. При нагревании выше 130 ºС подвергается термической диссоциации с образованием биурета и выделением аммиака:
2CO(NH2)2 = H2N – CO – NH – СО – H2N + NH3.
Водные растворы карбамида устойчивы до 80 ºС, при более высокой температуре разлагаются через образование карбоната аммония на аммиак и оксид углерода (IV):
CO(NH2)2 + 2H2O Û (NH4)2CO3 Û (NH4)2HCO3 + Û
Û CO2 + H2O + 2NH3.
Это исключает возможность длительного нагревания растворов карбамида при атмосферном давлении, например, в процессе выпаривания.
Карбамид – безбалластное высококонцентрированное МУ. Он легко усваивается растениями. Содержание азота в нем в амидной форме составляет 46,6%. По сравнению с нитратом аммония карбамид более богат азотом, меньше слеживается, не взрывоопасен в смесях с органическими веществами и медленнее вымывается из почвы.
1.3.2 Физико-химические основы процесса синтеза
В основе получения карбамида лежит взаимодействие аммиака с оксидом углерода (IV) с последующей дистилляцией продуктов синтеза и переработкой полученных растворов. При синтезе карбамида последовательно протекают две обратимых реакции:
образование карбамата аммония:
2NH3 + CO2 Û CO(NH2)(ONH4) – 121,6 кДж (1)
и дегидратации карбамата аммония до карбамида:
CO(NH2)(ONH4)ÛCO(NH2)2 + H2O–11,1 кДж (2)
Процесс синтеза описывается суммарным уравнением:
2NH3 + CO2 = CO(NH2)2 + H2O – 110,1кДж.
Он протекает в гетерогенной системе, состоящей из газообразной фазы (аммиак, диоксид углерода, пары воды) и жидкой фазы, включающей расплавленные и растворенные компоненты (аммиак, карбамат аммония, карбонаты аммония, карбамид) и воду.
Скорости реакций 1 и 2 различны. Реакция 1 протекает значительно быстрее реакции 2, поэтому лимитирующей процесс синтеза стадией, от которой и зависит выход продукта, является стадия дегидратации карбамата аммония 2. Состояние равновесия и скорость ее определяются температурой, давлением, соотношением аммиака и диоксида углерода и содержанием воды в реакционной смеси.
Скорость реакции 2 возрастает с увеличением температуры и давления. Так как она протекает с поглощением тепла, то повышение температуры одновременно способствует смещению равновесия вправо и увеличивает степень конверсии карбамата аммония.
Повышение температуры быстро смещает равновесие реакции 1 влево, что приводит к уменьшению концентрации карбамата и, следовательно, к падению скорости реакции 2 конверсии карбамата в карбамид.
Максимальная степень превращения карбамата аммония в карбамид достигается при температуре около 220ºС. При этой температуре продолжительность процесса составляет около 60 минут. При понижении температуры для достижения более высокой степени превращения карбамата в карбамид время процесса существенно увеличивается.
Скорость образования карбамата аммония возрастает пропорционально квадрату давления и при давлении 1 МПа протекает практически мгновенно.
Наибольшее влияние на выход карбамида оказывает избыток аммиака в исходной смеси сверх стехиометрического количества (NH3 : CO2 – 2 : 1). Избыток аммиака смещает равновесие реакции 1, а также вследствие своего дегидратирующего действия связывает реакционную воду, удаляя ее из сферы реакции, и смещает вправо равновесие реакции 2. Образование карбамата и его дегидратация до карбамида протекают в жидкой фазе, поэтому в реакторе должны быть созданы условия ее существования. Этому способствует увеличение степени заполнения реактора, что приводит к уменьшению объема газовой фазы, и нагрев реакционной смеси до температуры выше эвтектической точки системы «карбамат-карбамид», равной 98ºС.
Влияние различных факторов на состояние равновесия системы «карбамат-карбамид» можно представить в виде следующей схемы:
 Т (за счет
экзотермичности реакции 1)
Т (за счет
экзотермичности реакции 1)
сдвиг влево
сдвиг вправо
Р
(за счет ускоре- (за счет подав- NH3/CO2
ния наступления ления диссоци- (за счет связывания
равновесия ации карбамата воды в реакции 2)
в реакции 2) в реакции 1)
Оптимальный режим процесса синтеза карбамида должен обеспечить: быстрое и полное протекание реакции 1, протекание реакции 2 не менее, чем на 71%.
Этим условиям отвечают следующие параметры процесса: температура 180 - 200ºС, давление 20 МПа, избыток аммиака 100% сверх стехиометрического количества, то есть мольное отношение NH3 : CO2 – 4 : 1
1.3.3 Технологическая схема производства
В результате взаимодействия аммиака и оксида углерода (IV) образуется сложная система, состоящая из целевого продукта карбамида, полупродукта карбамата аммония, воды, карбонатов аммония и избытка аммиака. Для выделения из нее твердого карбамида и утилизации не вступивших в реакцию остальных компонентов и карбамата полученный раствор подвергают дистилляции. В процессе дистилляции отгоняется избыток аммиака и воды и происходит разложение карбонатов аммония (аммонийных солей).
В зависимости от того, возвращаются эти продукты в процесс или после отделения карбамида используются в других производствах (например, для получения нитрата аммония), технологические схемы производства карбамида делятся на две группы:
- без возвращения продуктов дистилляции в цикл (разомкнутая схема, без рецикла);
- с возвращением продуктов дистилляции в цикл (замкнутая схема, с рециклом).
В первом случае весь выделившийся при дистилляции аммиак поглощают азотной кислотой для получения нитрата аммония, при этом производство карбамида комбинируется с производством нитрата аммония.
Во втором случае продукты дистилляции частично (частичный рецикл) или полностью (полный рецикл) возвращаются в цикл на синтез карбамида. Существуют для варианта полного рецикла: газовый рецикл, при котором продукты дистилляции возвращаются в газообразном виде, и жидкостный рецикл, при котором они возвращаются в виде раствора аммонийных солей.
На рисунке 1.3. представлена принципиальная схема производства карбамида с полным жидкостным рециклом.
Аммиак Вода
![]()
![]()
![]()
![]()
![]()
![]()
![]() Синтез Дистилляия
Упаривание Карбамид
Синтез Дистилляия
Упаривание Карбамид
Диоксид Раствор
углерода аммонийных
солей
Рисунок 1.3 - Принципиальная схема с полным рециклом
Наиболее экономична технологическая схема с полным жидкостным рециклом, так как в ней не требуется сжатия возвращаемых в цикл горячих газов (аммиака и диоксида углерода), что может вызвать засорение трубопроводов образующимся твердым карбамидом и их коррозию.
На рис. 1.4 приведена технологическая схема производства карбамида с полным жидкостным рециклом и двухступенчатой дистилляцией плава мощностью 90 тыс. тонн в год.
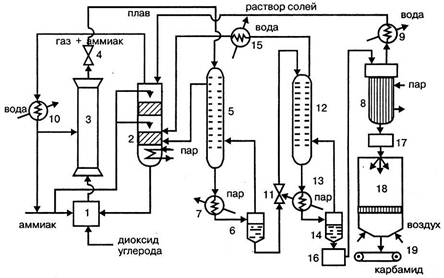
Рисунок 1.4 - Технологическая схема производства карбамида:
1 – смеситель аммиака, диоксида углерода и раствора аммонийных солей, 2 – промывная колонна; 3 колонна синтеза; 4, 11 – редукторы; 1 – ректификационная колонна I ступени; 6 сепаратор; 7, 13 – подогреватели; 8 – выпарные аппараты I и II ступеней; 9, 10, 11 – холодильники-конденсаторы; 12 – ректификационная колонна II ступени; 14 сепаратор II ступени; сборник раствора карбамида; 17 – сборник плава; 18 грануляционная башня; 19 – транспортер
Оксид углерода (IV), очищенный от примесей и сернистых соединений, сжатый до 20 МПа, и жидкий аммиак под давлением 11 МПа поступают в смеситель 1 при температуре 80 – 100ºС. Сюда же подается раствор аммонийных солей из промывной колонны 2. В смесителе обеспечивается мольное отношение NH3:CO2:H2O=4,1:1:0,1. Из смесителя смесь, разогревшаяся за сет частичного образования карбамата до 171ºС, направляется в нижнюю часть колонны синтеза 3, где заканчивается образование карбамата аммония, и он превращается на 61% в карбамид. Для обеспечения оптимального теплового режима в колонну дополнительно вводят жидкий аммиак. Из верхней части колонны плав после дросселирования в редукторе 4 подается на двухступенчатую дистилляцию. Агрегат дистилляции каждой ступени состоит из трех аппаратов: ректификационной колонны, подогревателя и сепаратора. Сначала плав поступает в ректификационную колонну 1 первой ступени 1, где давление снижается до 2 МПа. В колонну 1 из сепаратора первой ступени 6 подается противотоком газ. В колонне первой ступени проходит выделение карбамида из реакционной смеси, разложение карбамата аммония и образование из аммиака диоксида углерода и воды водного раствора аммонийных солей. Плав из колонны 1, пройдя подогреватель 7, поступает при температуре 160 ºС в сепаратор первой ступени 6, в котором разделяются жидкая и газообразная фазы. Газы возвращаются в колонну 1 и оттуда в нижнюю часть промывной колонны 2. Верхняя часть промывной колонны орошается жидким аммиаком и аммиачной водой, поступающей в виде конденсата из выпарного аппарата 8 через холодильник-конденсатор 9. В промывной колонне из газа вымывается диоксид углерода и образуется водный раствор аммонийных солей, а газообразный аммиак отводят из верхней части колонны и после сжижения в холодильнике-конденсаторе 10 возвращают в процесс. Водный раствор аммонийных солей перекачивается в смеситель 1 и оттуда в колонну синтеза 3. Раствор карбамида из сепаратора первой ступени 6 дросселируется до давления 0,3 МПа в редукторе II и подается в ректификационную колонну второй ступени 12, откуда поступает в подогреватель 13 и сепаратор 14. В колонне второй ступени происходят дальнейшее разложение карбамата до аммиака и диоксида углерода и образование водного раствора карбоната и бикарбоната аммония. Из нижней части сепаратора 14 выходит 70% раствор карбамида, а из верхней – парогазовая смесь, содержащая аммиак, диоксид углерода и пары воды, которая поступает в нижнюю часть ректификационной колонны 12. Газовая смесь из колонны 12 охлаждается в холодильнике-конденсаторе 11 и в виде раствора аммонийных солей подается в нижнюю часть промывной колонны 2. Раствор карбамида из сепаратора второй ступени 14 собирается в сборнике 16 и подается на упаривание последовательно в вакуум-аппараты первой и второй ступеней при температуре 140ºС и давлении 0,003 МПа. Полученный плав карбамида концентрацией около 0,998 мас. дол. поступает через сборник плава 17 в грануляционную башню 18 и распыляется в ней. Образовавшиеся гранулы при температуре около 70ºС транспортером 19 подают на операции классификации, охлаждения и упаковки. Выход карбамида в расчете на диоксид углерода составляет около 91%.
В последние годы в производстве карбамида был внедрен стриппинг-процесс, в котором разложение карбамата аммония в плаве ведут при давлении, близком к давлению синтеза, путем продувки плава сжатым диоксидом углерода. В этих условиях карбамат аммония диссоциирует за счет снижения парциального давления аммиака и сдвига равновесия реакции 1 влево. На принципе стриппинг-процесса в настоящее время работают установки большой единичной мощности 1000 – 1100 т/сут. Технологическая схема подобного процесса представлена на рисунке 1.1.
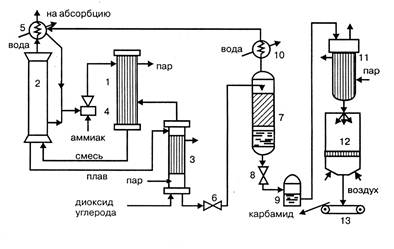
Рисунок 1.1 - Технологическая схема стриппинг-процесса
1 – конденсатор высокого давления; 2 – колонна синтеза; 3 – отдувочная колонна; 4 – инжектор; 1 скруббер; 6 – редуктор; 7 – ректификационная колонна; 8 – редуктор; 9 – сборник раствора; 10 – холодильник- конденсатор; 11 – выпарной аппарат; 12 – гранулятор; 13 – транспортер
Из конденсатора высокого давления 1 в нижнюю часть колонны синтеза 2 поступают водный раствор карбамата аммония, аммонийных солей, аммиак и диоксид углерода. Образовавшийся плав направляется в отдувочную колонну 3, обогреваемую паром, в которую противотоком поступает под давлением 11 МПа диоксид углерода. Из колонны 3 парогазовая смесь, содержащая свежий диоксид углерода, поступает в конденсатор высокого давления 1, куда через инжектор 4 вводится жидкий аммиак. Он одновременно служит рабочим телом в инжекторе, подающем в конденсатор раствор аммонийных солей из скруббера 1 и часть плава из колонны синтеза. В конденсаторе образуется карбамат, а тепловой эффект реакции используют для выработки пара. Непрореагировавшие в колонне синтеза газы и пары воды поступают в скруббер высокого давления 1, в котором конденсируются и через инжектор 4 направляются в конденсатор высокого давления 1. Водный раствор карбамида, выходящий из отдувочной колонны 3, содержит до 1% карбамата аммония. Для его разложения раствор дросселируют в редукторе 6 до давления 0,3 – 0,6 МПа и направляют в верхнюю часть ректификационной колонны 7. В ней жидкая фаза в виде 70% раствора карбамида стекает вниз и после снижения давления до 0,1 МПа в редукторе 8 собирается в сборнике раствора 9. Водяные пары, выходящие из ректификационной колонны 7, конденсируются в холодильнике-конденсаторе 10, растворяя содержащиеся в них аммиак и диоксид углерода, и полученный раствор аммонийных солей направляется в скруббер 2. Раствор карбамида из сборника 9 поступает в выпарной аппарат 11 и после упаривания в грануляционную башню 12, откуда в виде гранул направляется транспортером 13 на склад.
Стриппинг-процесс производства карбамида позволяет использовать тепловой эффект реакции образования карбамида, упростить технологическую схему, сократить количество оборотной воды и, в целом, является поэтому более экономичным, чем обычный.
Дальнейшее совершенствование производства карбамида заключается в создании интегральных схем, объединяющих производство карбамида, аммиака и нитрата аммония, повышении единичной мощности установок, внедрении технологических схем со стриппинг-процессом.
В заключении в табл.1.2 приведены расходные коэффициенты в производстве нитрата аммония и карбамида.
Таблица 1.2 –
Расходные коэффициенты в производстве азотных удобрений
| Сырье и энергия (на тонну готового продукта) | Производство нитрата аммония в установке АС-72М | Производство карбамида | |
| Полный жидкостный цикл | Стриппинг- процесс | ||
| Аммиак, т | 0,214 | 0,18 | 0,176 |
| Диоксид углерода, т | - | 0,77 | 0,71 |
| Азотная кислота, т | 0,786 | - | - |
|
Вода, м3 |
0,1 | 100 | 87 |
| Электроэнергия, кВт·ч | 21,1 | 110 | 120 |
| Пар, т | 0,214 | 1,1 | 1,01 |
© 2009 База Рефератов