
Рефераты по рекламе
Рефераты по физике
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по хозяйственному праву
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Реферат: Розробка живої культуральної вакцини проти вірусної діареї великої рогатої худоби
Реферат: Розробка живої культуральної вакцини проти вірусної діареї великої рогатої худоби
УКРАЇНСЬКА АКАДЕМІЯ АГРАРНИХ НАУК
НАЦІОНАЛЬНИЙ НАУКОВИЙ ЦЕНТР
«ІНСТИТУТ ЕКСПЕРИМЕНТАЛЬНОЇ І КЛІНІЧНОЇ ВЕТЕРИНАРНОЇ МЕДИЦИНИ»
МАЛАКЄЄВА-ЧЕБАНЮК ІРИНА ВЛАДИСЛАВІВНА
УДК 619:616.98:578.833.3:615.371
Розробка живої культуральної вакцини проти вірусної діареї великої рогато худоби
16.00.03 ветеринарна мікробіологія та вірусологія
ABTOPEФЕРAT
дисертац на здобуття наукового ступеня
кандидата ветеринарних наук
Харків 2008
Дисертацією є рукопис.
Робота виконана в Національному науковому центрі «Інститут експериментальної і клінічної ветеринарно медицини».
Наукові керівники: доктор ветеринарних наук, професор, академік УААН Фукс Поліна Павлівна, Інститут експериментальної і клінічно ветеринарної медицини УААН;
кандидат ветеринарних наук, старший науковий співробітник Стеценко Володимир Іванович, Національний науковий центр «Інститут експериментально клінічної ветеринарної медицини», завідувач відділу вірусології.
Офіційні опоненти: доктор ветеринарних наук, професор Білокінь Віктор Степанович, Національний науковий центр «Інститут експериментальної і клінічної ветеринарної медицини», завідувач відділу біотехнолог та біохімії;
кандидат ветеринарних наук, старший науковий співробітник Кучерявенко Олександр Олександрович, Інститут ветеринарної медицини УААН, провідний науковий співробітник лабораторії з вивчення лептоспірозу сільськогосподарських тварин.
Захист відбудеться « 29 » квітня 2008р. о « 9. 30 » годині на засіданні спеціалізованої вченої ради Д 64.359.01 в Національному науковому центрі «Інститут експериментальної і клінічної ветеринарної медицини» за адресою: 61023, м. Харків, вул. Пушкінська, 83.
З дисертацією можна ознайомитись у бібліотеці Національного наукового центру «Інститут експериментальної і клінічної ветеринарної медицини» за адресою: 61023, м. Харків, вул. Пушкінська, 83.
Автореферат розісланий « 26 » березня 2008 р.
Учений секретар
спеціалізованої вченої ради,
доктор ветеринарних наук, професор А.Ф. Бабкін
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Вірусна діарея (ВД) має значне поширення серед великої рогатої худоби майже в усіх країнах світу. Вона характеризується високою контагіозністю, розвитком ерозивно-виразкового запалення слизових оболонок травного тракту, ураженням респіраторних і статевих органів, а також суглобів (Білокінь В.С., 1971; Жидков С.А., 1994; Сюрин В. Н., 1998; Стеценко В. І., 1999; Greiser-Wilke K., 2002; Годовський О.В., 2007). У більшості випадків вірусна діарея перебігає в латентній формі, у тільних корів спричиняє інфікування плодів, аборти, мертвонародження або народження слаборозвинених телят з вираженою мунологічною толерантністю (Гуненков В.В. та ін., 1982; Цибанов С.Ж. та ін., 1995; Molnar E. et al., 2002; Кучерявенко В.В., 2005).
Різноманітність клінічних проявів хвороби та особливості біологічних властивостей збудника ускладнюють діагностику та заходи щодо профілактики вірусно діареї.
Збудник вірусної діареї належить до родини пестивірусів, має антигенну спорідненість із вірусом класичної чуми свиней та пограничної хвороби овець (Darbyshire F.H., 1960; Крюков Н. Н. и др., 1978; Чермашинцев В. И. и др., 1996; Бабкін М. В., Стеценко В.І., 1997), досить стійкий в умовах довкілля. Його нфекційність за температури мінус 20 єС зберігається впродовж 30 діб, а за мінус 40 єС – протягом декількох років. Він добре розмножується як у культурах первинно трипсинізованих, так і перещеплюваних клітин (Гизитдинов Н.Н. и др., 1977; Файзулина С.И. и др., 1977; Куликова И.Л. и др., 1992; Закутский И. И. и др., 1995; Ким Т. Г. и др., 1995; Білокінь В.С. та ін., 1997; 2000; Шульгин М. И. и др., 2003; Baker F. C., 1990; Becher P. et al., 2001; Bruschke C.F. et al., 1998; Glandaspero M. et al., 1998; Campen H. et al., 2001, Kelling C.L. et al., 2002).
Важливим фактором, який сприяє поширенню збудника, є особливість вірусної діареї перебігати в прихованій формі. Вірус може тривалий час персистувати в організмі клінічно здорових дорослих тварин, виділятися в зовнішнє середовище та заражати молодняк.
Наявність латентної форми й різноманітність прояву клінічних ознак у тварин різного віку потребують особливої стратегії щодо профілактики вірусної діареї велико рогатої худоби в неблагополучних господарствах, в яких хвороба перебігає в найбільш тяжкій формі серед телят, спричиняючи їх загибель.
На сьогодні нема сумніву, що в патології молодняка великої рогатої худоби вірусна діарея є однією з провідних інфекцій. В Україні, на жаль, вірусній діареї приділяється недостатньо уваги, що створює передумови її значного поширення в різних регіонах нашої країни.
Значні економічн збитки, яких завдає вірусна діарея, зумовлені вищезазначеними особливостями її збудника та різноманітними формами перебігу.
Найбільш ефективним засобом боротьби з вірусною діареєю великої рогатої худоби є вакцинація сприйнятливого поголів’я тварин. Проте до 2005 року в Україні не було розроблено і впроваджено для застосування засобів специфічної профілактики вірусної діареї.
Аналіз фактичного матеріалу, накопиченого вітчизняними й закордонними дослідниками, свідчить про складність отримання та застосування вакцини проти вірусної діареї. Відносно невисока ефективність нактивованих вакцин (Neaton H.J. et al., 1986; Sweat R.L., 1986; Сергеев В.А., 1993; Vogel F.S.F., 2001) визначила напрямок експериментальних досліджень щодо отримання атенуйованих штамів вірусу діареї з метою використання їх як вірус-вакцини. Жив вакцини забезпечують швидке формування локального та системного імунітетів і запобігають нфікуванню тварин епізоотичним вірусом діареї.
Актуальність цього напрямку досліджень ґрунтується також на тому, що в телят у перші доби життя імунна система ще недосконала і в разі застосування інактивованих вакцин не відбувається негайна повноцінна імунна відповідь, а колостральний імунітет короткочасний і залежить від рівня материнського імунітету.
На підставі вищезазначеного було заплановано здійснити дослідження з розробки технології виготовлення живо вакцини проти діареї великої рогатої худоби та відпрацювати схему її застосування в неблагополучних господарствах.
Зв’язок роботи з науковими програмами, темами, планами. Дисертаційна робота є складовою частиною наукових досліджень, виконаних згідно з державними програмами і тематичними планами ННЦ «Інститут експериментальної і клінічної ветеринарної медицини», зокрема, завдання 05 «Розробити ефективну систему діагностики, терапії та профілактики хвороб велико рогатої худоби» (№ державної реєстрації 01974000758, 2000 р.); 05 «Розробити та впровадити комплексну систему діагностики, терапії та профілактики інфекційних незаразних хвороб жуйних тварин» (№ державної реєстрації 0101U001610, 2001–2005 рр.); завдання 37.02-003 «Вивчити біологію герпес- і пестивірусів – збудників інфекційного ринотрахеїту та вірусної діареї великої рогатої худоби, розробити сучасні засоби х діагностики й специфічної профілактики» (№ державної реєстрації 0106U000340, 2006–2010 рр.).
Мета і завдання дослідження. Основна мета роботи – розробити засоби специфічної профілактики вірусної діареї велико рогатої худоби в неблагополучних господарствах.
Для досягнення поставлено мети необхідно було вирішити такі завдання:
- підібрати клітинну систему для культивування й накопичення виробничого штаму вірусу діареї;
- вивчити інфекційну активність та антигенні властивості виробничого штаму вірусу діареї;
- визначити щепну дозу вакцини за показниками інфекційності виробничого штаму ВД та скомпонувати склад;
- випробувати й дати оцінку властивостей вакцини за такими показниками якості: стерильністю, реактогенністю, нешкідливістю, антигенними властивостями та імуногенністю;
- вивчити імуномодулюючу дію бактеріального ліпополісахариду на розвиток імунітету під час застосування живо вакцини проти вірусної діареї.
Об’єкт дослідження: вірусна діарея великої рогато худоби та специфічні засоби її профілактики.
Предмет дослідження: клітинні культури, виробничий штам вірусу діареї, бактеріальний ліпополісахарид, імунобіологічні властивості вакцини, післявакцинальний імунітет.
Методи дослідження. Робота виконана з використанням вірусологічних, бактеріологічних, серологічних, імунологічних, біохімічних, гематологічних та статистичних методів досліджень.
Наукова новизна одержаних результатів. На підстав здійснених уперше в Україні досліджень розроблено живу культуральну вакцину проти вірусної діареї великої рогатої худоби, для виготовлення якої використано модифікований виробничий штам ВК–1М, репродукований у моношаровій культурі перещеплюваних клітин КСТ; створено препаративну форму сухого біопрепарату. Розроблена вакцина забезпечу високий рівень індукції вірусонейтралізуючих антитіл в організмі щеплених телят запобігає клінічному прояву захворювання.
З метою корекції післявакцинального мунітету визначено доцільність застосування ліпополісахариду, виготовленого з культури Bacillus аlvei, одночасно з щепленням живої вакцини проти вірусної діареї.
Наукова новизна розробок підтверджена деклараційним патентом на корисну модель України № 5153 «Спосіб профілактики вірусної діареї великої рогатої худоби», (заявл. 12.07.2004 р., опубл. 15.02.2005 р.).
Практичне значення одержаних результатів поляга в тому, що для використання пропонуються жива культуральна вакцина проти вірусно діареї та імуностимулятор – ліпополісахарид з культури Bacillus аlvei, а також спосіб їх одночасного застосування з метою специфічної профілактики вірусно діареї великої рогатої худоби в неблагополучних господарствах.
За результатами здійснених досліджень розроблено й подано на експертизу в Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів та узгодження в Державному комітеті ветеринарної медицини України нормативну документацію (інструкція з виготовлення та контролю за показниками якості вакцини живої культурально проти вірусної діареї великої рогатої худоби, ТУУ на вакцину та листівка-вкладка щодо застосування цього біопрепарату), яку розглянуто та схвалено на засіданні методично комісії ІЕКВМ УААН (протокол № 16 від 8 грудня 2004 року).
Особистий внесок здобувача. Авторка особисто здійснила аналіз літературних джерел за темою дисертації, самостійно виконала експериментальну частину роботи, зокрема, з підбору клітинної системи для культивування виробничого штаму вірусу діареї, розробила спосіб накопичення вірусної сировини для виготовлення вакцини, вивчила властивості вакцини за показниками якості, запропонувала корекцію післявакцинального імунітету за допомогою бактеріального ліпополісахариду.
Біохімічні та гематологічн дослідження здійснено спільно із співробітниками лабораторії біохімії ННЦ «ІЕКВМ», кандидатами біологічних наук Л. В. Коваленко та С. А. Михайловою.
Апробація результатів дисертації. Матеріали, подані в дисертації, доповідались і були схвалені на звітних сесіях Вченої ради засіданнях методичної комісії ННЦ «ІЕКВМ» (2000–2007 рр.) та міжнародних науково-практичних конференціях: «Ветеринарна медицина – 2004. Сучасні аспекти розробки, маркетингу виробництва ветеринарних препаратів», (24–31 травня 2004 р., м. Феодосія), «Ветеринарна медицина – 2005. Сучасний стан та актуальні проблеми забезпечення ветеринарного благополуччя тваринництва», (30 травня–4 липня 2005 р., м. Ялта).
Публікації. Основні положення дисертац опубліковано в 5 наукових працях, з них 1 одноосібна, у фахових виданнях, перелік яких затверджений ВАК України, та описі отриманого деклараційного патенту.
Структура дисертації. Дисертація викладена на 110 сторінках комп’ютерного друку і містить такі розділи: вступ, огляд літератури, матеріали та методи досліджень, результати власних досліджень, їх узагальнення та аналіз, висновки, пропозиції виробництву, список використаної літератури за темою дисертації, додатки. Робота ілюстрована 7 рисунками і 15 таблицями. У списку літератури наявні 240 джерел, у тому числі 143 – закордонних авторів.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕНЬ
Робота виконана відповідно до державних і відомчих планів наукових досліджень у лабораторіях вивчення хвороб молодняка та вивчення вірусних хвороб рогатої худоби Національного наукового центру «Інститут експериментальної і клінічної ветеринарної медицини», а також у дослідному господарстві «Українка Слобідська» та СВК «Заповіт Леніна» Харківської області впродовж 2000–2007 років. Окремі етапи цих досліджень, зокрема біохімічні, здійснено в лаборатор біохімії ННЦ «ІЕКВМ».
Для розроблення, виробництва та випробування живої вакцини проти вірусної діареї використали такі штами: епізоотичний 25, еталонний Oregon C 24 V і виробничий ВК-1М вірусу діареї з колекції лаборатор вивчення вірусних хвороб рогатої худоби. Виробничий штам ВК-1М вірусу діареї отриманий В.І. Стеценком шляхом адаптації до розмноження епізоотичного ізоляту ВК-1, що був виділений у 1972 році від хворої на вірусну діарею ВРХ, і подальшої його атенуац шляхом серійних пасажів у культурах перещеплюваних клітин. Титр його інфекційност після 20 і 30 послідовних пасажів у культурах перещеплюваних клітин ПТ і ПО становив відповідно 6,5 і 6,8 lgТЦД50/см3. Титр інфекційності штамів 25 та Oregon C 24 V під час культивування в цих культурах становив 6,0 і 5,8 lg ТЦД 50/см3 та 6,2 і 6,0 lg ТЦД50/см3, відповідно.
Окрім того, в робот використали ліпополісахарид (ЛПС-1), який застосовували як імуностимулятор під час мунізації тварин живою вакциною проти вірусної діареї, виготовлений за методом П.А. Красочко та В.А. Машеро (1998) шляхом лужного гідролізу бактеріальної маси культури Bacillus alvei, (штам 413), з колекції лабораторії вивчення хвороб бджіл ННЦ «ІЕКВМ».
За допомогою тест-культури Staphilococcus aureus (штам 209 Р) визначали фагоцитарну активність та фагоцитарне число нейтрофілів периферійної крові.
Культивування досліджуваних штамів вірусу діареї та накопичення вихідної вірусовміщуючої сировини для виготовлення зразків вакцини здійснювали в моношарових культурах перещеплюваних клітин ТрТ (трахея теляти), ВНК-21/13 (нирки новонародженого хом’ячка) та КСТ (коронарні судини теляти), які вирощували в суміші з рівних об’ємів середовищ Ігла та 199 з 10 % сироватки крові ВРХ виробництва ДП «Ветеринарна медицина» (м. Харків). Концентрацію та життєздатність клітин визначали за фарбуванням трипановим синім і підрахуванням живих клітин у камері Горяєва.
Експериментальні дослідження з вивчення реактогенності, нешкідливості, антигенних та імуногенних властивостей виробничого штаму ВК-1М вірусу діареї та дослідних зразків вакцини виконувались на 300 білих мишах масою 18–20 г, 60 морських свинках масою 300–400 г, 40 кроликах породи Шиншила масою 2,0–2,5 кг та 99 телятах 21–28-добового (n=36) та 3–4-місячного віку (n=63).
Чутливість перещеплюваних клітин до вірусу діареї вивчали в п’яти послідовних пасажах з визначенням його інфекційност шляхом титрування, для чого готували 10‑кратні розведення, якими заражали по 4 тест-об’єкти (пробірочні культури клітин). Результати обраховували за методом Ріда і Менча. За титр інфекційності приймали максимальне розведення вірусу, що спричиняло деструкцію клітин у 50 % флаконів, і виражали в тканинних цитопатогенних дозах (ТЦД 50/см3). Антигенну активність вірусу та імуногенність зразків вакцини досліджували за допомогою реакції нейтралізації ЦПД вірусу специфічними антитілами в сироватках крові тварин, щеплених відповідним штамом вірусу діареї. За титр нейтралізуючо активності сироватки крові приймали ті розведення сироватки, в яких спостерігали пригнічення репродукції вірусу в 50 % культуральних флаконів (пробірок).
Імунний стан тварин оцінювали за показниками рівня вірусонейтралізуючих антитіл, функціональної активності гематогенних попередників макрофагів, зокрема макрофагальної трансформації мононуклеарів, фагоцитарного індексу, фагоцитарного числа за методом В.Н. Чеботкевича і С.И. Лютинского (1998).
Кількість імуноглобулінів визначали за G. Manchini et al. (1965) та Н. В. Кленіною із співавт. (1983), циркулюючих імунних комплексів – за методом Ю. А. Гриневича.
Лейкоцитарну формулу обраховували за кількістю елементів білої крові в мазках, пофарбованих за Романовським-Гімза.
Статистичну обробку результатів досліджень здійснювали з визначенням критеріїв вірогідності за Ст’юдентом. Облік результатів обраховували за допомогою персонального комп’ютера IBM PC/AT, програми «Excel XP» з програмного пакету MS Office XP.
РЕЗУЛЬТАТИ ВЛАСНИХ ДОСЛІДЖЕНЬ
Вибір клітинної системи для культивування вірусу діареї. Важливим етапом виробництва біологічних препаратів є вибір клітинної системи для репродукції вірусу, яка б забезпечувала максимальне накопичення вірусовміщуючого матеріалу. Із цією метою ми випробували три лінії перещеплюваних клітин, а саме: ТрТ, КСТ і ВНК‑21/13, які підтримуються в колекції ННЦ «ІЕКВМ». У результат порівняльного вивчення культуральних властивостей клітин цих ліній установлена залежність накопичення їхньої біомаси від посівної концентрації та способу вирощування. З збільшенням посівної концентрації від 100 до 400 тисяч клітин в 1 см3 ростового середовища скорочуються терміни формування моношару як за стаціонарного (в матрасах), так і ролерного (у бутлях) способів вирощування. Зокрема, під час культивування в матрасах і бутлях ці показники для культури клітин ТрТ скорочувалися відповідно від 144 до 72 годин і від 120 до 60 годин, для КСТ – від 120 до 70 від 72 до 40 годин, і для ВНК-21/13–від 80 до 48 і від 72 до 38 годин. За кількістю накопичення клітин у моношарі переваги мала культура КСТ (771,5 і 1449,0 тисяч клітин/см3 середовища відповідно в матрасах і бутлях порівняно з ТрТ (740 і 1400 тис/см3) ВНК-21/13 (767 і 1440,5 тис/см3).
На підставі отриманих результатів експериментальних досліджень основних параметрів процесу вирощування клітинної біомаси культура перещеплюваних клітин КСТ визнана нами більш продуктивною як за вирощування в матрасах, так і ролерних бутлях та обрана для використання в подальшому виробництві дослідних зразків вакцини проти вірусної діареї.
Вивчення репродуктивних властивостей виробничого штаму вірусу діареї. Результати вивчення культуральних і репродуктивних властивостей трьох ліній перещеплюваних клітин визначили доцільність з’ясування в порівняльному аспекті їхньої чутливості до вірусу діареї, зокрема до штамів 25, Oregon C 24 V та ВК-1М. Із нарощуванням пасажів вірусу цитопатичні зміни в культурах клітин стабілізувалися за терміном прояву й завершення. Із ростом серійних пересівів вірусу цей термін скорочувався. У 5-му пасажі терміни завершення ЦПД становили в матрасах 48–76, а в бутлях – 42–72 години залежно від випробуваних клітин. Із посиленням адаптац до репродукції в цих клітинних культурах титр інфекційності штамів 25, Oregon C 24 V і ВК-1М ВД підвищувався майже на 1,0 lg ТЦД 50/см3. Що стосується штаму ВК-1М, то результати пасажування засвідчили його більш виражену стабільну репродуктивну здатність у досліджуваних культурах клітин. У ролерній культур перещеплюваних клітин КСТ вона досягала максимального рівня – 7,6 lg ТЦД50/см3.
Разом із тим ми встановили пряму залежність термінів репродукц вірусу від заражаючої дози. Оптимальні показники терміну репродукції штаму ВК–1М у перещеплюваній культурі клітин забезпечувала множинність зараження з розрахунку 0,001 ТЦД50/клітину, що відповідає інфекційності вірусу 100 ТЦД50/см3. Із підвищенням множинності зараження до 0,01 ТЦД50/клітину, що становить 1000 ТЦД50/см3 у заражаючому об’ємі вірусовміщуючої суспензії, термін репродукції вірусу скорочувався в середньому на 6 годин. Але титр інфекційност кінцевої вірусовміщуючої сировини був однаковим як за множинності зараження 0,001 ТЦД50/клітину, так і 0,01 ТЦД50/клітину. У подальшому процес напрацювання вихідної вірусовміщуючої сировини для виготовлення вакцини здійснювали зараженням культури КСТ із розрахунку 0,01 ТЦД50 вірусу на клітину.
На підставі отриманих результатів досліджень щодо вибору чутливої тест-системи для ролерного культивування та вивчення репродуктивної активност випробуваних штамів вірусу діареї встановлено, що за цими показниками штам ВК‑1М вірусу діареї ВРХ відповідає вимогам до інфекційності виробничого штаму, призначеного для виготовлення вакцини (табл. 1).
Зокрема, оптимальною є доза зараження моношарової культури клітин КСТ як у матрасах, так і в бутлях у співвідношенні 1:20 і 1:30 об’єму вірусу з титром інфекційності 1000 ТЦД50/см3 і підтримуючого поживного середовища, що відповідає інфекційності вірусу 0,01 ТЦД50/клітину, яка забезпечує максимальну репродукцію штаму ВК-1М ВД упродовж 40 годин із кінцевими титрами 6,6 і 7,6 lg ТЦД50/см3 відповідно.
Таблиця 1
Властивості виробничого штаму ВК–1М ВД
| Показники | Необхідн параметри | ||
| матраси | бутлі | ||
| Оптимальна доза зараження | співвідношення об’єму вірусу й підтримуючого середовища | 1:20 | 1:30 |
| Інфекційна активність вірусу в заражаючій дозі |
ТЦД 50/см3 |
1000 | 1000 |
| Множинність зараження |
ТЦД50/клітину |
0,01 | 0,01 |
| Час репродукції в моношаровій культурі клітин КСТ за ролерного культивування | годин | 40 | 40 |
| Титр нфекційності вихідної сировини |
lg ТЦД 50/см3 |
6,6 | 7,6 |
Після відпрацювання технології культивування й накопичення біомаси вірусу діареї ми здійснили дослідження щодо її звільнення від клітинного детриту.
Як засвідчили результати цих досліджень, виконаних на модел штаму ВК–1М вірусу діареї, осадження клітинного детриту за методом спонтанної седиментац й центрифугування за 2500 g упродовж 30–ти хвилин забезпечувало відповідно отримання прозорої вірусовміщуючої рідини на 34–35 і 44–45 % порівняно з дистильованою водою (табл. 2).
У той же час очистка не впливала на інфекційну активність вірусу, яка залишалася фактично на одному рівні як до, так і після видалення клітинного детриту шляхом седиментації та центрифугування, й становила відповідно 7,55 і 7,6 lg ТЦД 50/см3.
Таблиця 2
Порівняльна оцінка способів очистки вірусу діареї M±n, n=3
| Спосіб очистки | Ступінь очистки за прозорістю,% |
Кількість білка, мкг/см3 |
Титр нфекційності, lg ТЦД50/см3 |
||
| до очистки | після очистки | до очистки | після очистки | ||
| Седиментація | 34–35 | 2185 | 1845 | 7,60±0,15 | 7,55±0,25 |
| Центрифугування | 44–45 | 2185 | 1148 | 7,60±0,15 | 7,60±0,10 |
Однак отримані дані свідчать про те, що центрифугування за 2500 g протягом 30‑ти хвилин сприяє більш швидкому та ефективному очищенню вірусовмісної суспензії від клітинного детриту й загального білка, на підставі чого в подальшому застосовували цей метод під час виготовлення дослідних зразків живо вакцини проти вірусної діареї, хоча цей спосіб є більш затратним порівняно із седиментацією, що впливає на собівартість препарату.
Вивчення антигенних властивостей виробничого штаму ВК–1М вірусу діареї. Відомо, що в процесі конструювання вакцинних препаратів на основ атенуйованих штамів вірусу важливим є визначення їхніх антигенних властивостей. Здатність атенуйованого штаму ВК-1М вірусу діареї, обраного нами як виробничий, ндукувати в організмі тварин вірусоспецифічні антитіла вивчалась у порівняльному аспекті із штамами 25 і Oregon C 24 V як можливими компонентами для створення вакцини. Дослід здійснено на кроликах, які були сформовані в групи по 5 голів з розрахунку на штам вірусу діареї, який вводили одноразово внутрішньом’язово у відповідній дозі, а саме: Oregon C 24 V – 2Ч105,7 і 2Ч107 ТЦД50/гол., 25 – 2Ч105,7 і 2Ч107 ТЦД50/гол. і ВК-1М – 2Ч106,6 і 2Ч107,6 ТЦД50/гол. відповідно першого та п’ятого їх пасажів у культурі клітин.
Установлено, що як у першому, так і в п’ятому пасажах у культурі перещеплюваних клітин КСТ досліджувані штами зберігають здатність індукувати в організмі кроликів вірусонейтралізуючі антитіла, які виявлялися вже на 7 добу після введення та фактично утримувалися на одному рівні до 14 доби (термін спостереження) у титрах 6,0–6,7 lоg2 і 6,3–6,8 lоg2. Отримані дані свідчать про антигенну стабільність досліджуваних штамів, зокрема атенуйованого штаму ВК‑1М, як у процесі адаптації до нових умов культивування, так і в пасажах у перещеплюваній культурі клітин КСТ.
Конструювання живої вакцини проти вірусно діареї великої рогатої худоби. Для виготовлення вакцини використовували культуральну суспензію, отриману в результаті репродукції штаму ВК–1М вірусу діареї в моношаровій культур клітин КСТ, вирощеній у ролерних 3-літрових бутлях. Після одноразового заморожування відтавання вірусовміщуючу суспензію центрифугували 30 хвилин за 2500 g для видалення клітинного детриту й визначали інфекційний титр шляхом зараження моношарової культури клітин десятикратними розведеннями вірусу. Титр інфекційної активності вірусу в цій культурі був на рівні 7,6 ± 0,1 lg ТЦД50/см3.
Нами було виготовлено два дослідних зразки вакцини, один з яких був висушений методом ліофілізації в умовах ННЦ «ІЕКВМ». У процесі виготовлення ліофілізованого зразка вакцини використовували захисне середовище, яке готували з рівних об’ємів 50 % сахарози і 25 % желатину, після змішування яких із вірусовміщуючою культуральною суспензією у співвідношенні 1:9 кінцева концентрація становила 5,6 % і 2,8 %, відповідно. Під час вивчення інфекційної активності встановлено, що в процесі ліофілізації вона зменшувалася на 2,15 lg ТЦД50/см3 порівняно з вихідним показником (табл. 3). Проте антигенна активність вірусу не змінювалася. Титри вірусонейтралізуючих антитіл у пробах сироватки крові, відібраної у кроликів через 7 і 14 діб після щеплення досліджуваних зразків рідкої та сухої вакцин, були фактично однаковими (6,5 ± 0,2 і 6,3 ± 0,3 log2).
Таблиця 3
Вплив ліофілізації вакцини на інфекційність та антигенну активність вакцинного вірусу діареїn=3
| Зразок вакцини |
Титр нфекційності, lg ТЦД50/см3 |
Титр ВН-антитіл, log2(М±м) |
|
| 7 діб | 14 діб | ||
| Рідка (нативна) | 7,6±0,1 | 6,2±0,1 | 6,5±0,2 |
| Ліофілізована | 5,45±0,3 | 6,0±0,2 | 6,3±0,3 |
Вивчення вакцини за показниками якості. Кожний зразок вакцини (рідко сухої) проти ВД ВРХ перевіряли на контамінацію сторонніми мікроорганізмами, нешкідливість, антигенну та імуногенну активність. Контроль на контамінацію бактеріями та грибами здійснювали відповідно до ГОСТ 28085-89 «Препараты биологические. Метод контроля стерильности» та згідно з ДСТУ 4483:2005 «Препарати ветеринарні імунобіологічні. Методи визначення бактеріальної і грибкової контамінації». Проростів у вигляді помутніння, змін кольору або газоутворення в інокульованих бактеріологічних середовищах не спостерігали у всіх трьох послідовних пасажах досліджуваних проб, що свідчило про відсутність забрудненості бактеріями й грибами. Контамінацію досліджуваних зразків вакцини мікоплазмами виключали за результатами висівів у середовище Едварда. У трьох послідовних пересівах кожного зразка вакцини в напіврідкому агарі не виявлено завислих, напівпрозорих, у вигляді крапель, а на напівтвердому агарі - росту випуклих соскоподібних колоній мікоплазм.
З урахуванням вимог Європейських стандартів здійснювали контроль вакцини на контамінацію сторонніми вірусами. Відсутність ЦПД у моношаровій культурі клітин у трьох послідовних пасажах суміші вірусу діареї й специфічної сироватки крові вказувало на те, що дослідні зразки були вільними від сторонніх цитопатогенних вірусів.
Нецитопатогенні віруси визначали за методом гемадсорбції. У жодному випадку не спостерігали адсорбцію еритроцитів морської свинки на моношар клітин, які попередньо інокулювали сумішшю вакцини й специфічної до вірусу діаре сироватки крові.
Отже, розроблена технологія забезпечувала накопичення вихідно вірусовміщуючої культуральної суспензії з високою інфекційністю та виготовлення сухої форми вакцини, не контамінованих сторонніми мікроорганізмами.
Вивчення реактогенності вакцини. Реактогенність виготовлених зразків вакцини проти вірусної діареї, виготовлених із штаму ВК-1М, вивчали в дослідах на кроликах. Зразки середніх проб рідкої та сухої культуральної вакцин вводили підшкірно в об’ємі 2 мл, що відповідало 2Ч107,6 і 2Ч105,45 ТЦД50/гол., дворазово з інтервалом у 14 діб. У кроликів, щеплених сухим зразком вакцини із штаму ВК-1М і вірусовміщуючою культуральною суспензією штамів 25, Oregon C 24 V, не спостерігали відхилень від нормального клініко-фізіологічного стану, температура тіла була в межах норми.
За результатами гематологічних досліджень у тварин, яким вводили культуральну суспензію штамів 25 і Oregon C 24 V, установлено деяке зниження кількості лейкоцитів у межах 0,5–0,6 тисяч/мм3, а починаючи від 14 доби вона поступово поновлювалась і на 24 добу після щеплення сухої вакцини чи то вірусовміщуючо суспензії досліджуваних штамів 25 і Oregon C 24 V досягала вихідних показників.
Збільшення кількості нейтрофілів супроводжувалося підсиленням фагоцитарної реакції у кроликів у перші доби і її зменшенням та послабленням фагоцитарно реакції на 7–14 доби після щеплення сухого зразка вакцини із штаму ВК–1М і вірусовміщуючо культуральної суспензії штамів 25 і Oregon C 24 V.
У кроликів, яким щепили сухий зразок вакцини проти вірусно діареї зі штаму ВК‑1М, ці показники були виражені менше. Фагоцитарне число та фагоцитарний індекс у цих тварин знижувалися лише на 4,4 % і 0,4 одиниці порівняно з вихідними показниками, що свідчить про слабко виражену реактогенність вакцини з атенуйованого штаму ВК–1М вірусу діареї, тим більше, що він не призводив до проявлення вираженої лейкопенії.
Перевірка нешкідливост сухого зразка вакцини проти вірусної діареї. Нешкідливість вакцини культуральної живо проти вірусної діареї перевірялася на білих мишах і серонегативних до вірусу діаре телятах. Установлено, що вона нешкідлива для піддослідних тварин, у яких у місцях введення препарату не виявлено набряку, припухлості, затвердіння тканин або болісно реакції при пальпації. За підшкірного введення білим мишам вакцини в дозі 0,2Ч105,45ТЦД50/гол. під час спостереження впродовж 14 діб (інтервал між дворазовим щепленням вакцини) не спостерігали відхилення у їх загальному стані. У той же час у телят 5‑кратна доза (10Ч105,45 ТЦД50/гол.) вакцинного вірусу викликала незначне зниження кількості лейкоцитів. Зокрема, у теляти, в якого було виявлено одноразове підвищення температури тіла (на другу добу увечері) на 1 °С, кількість лейкоцитів понизилась від 7180±96 до 6685±114 кл./мм3 (на 495 кл./мм3), а в теляти, в якого не встановлено температурної реакції, від 7768±123 до 7463±110 (на 305 кл./мм3), що підтверджує слабку реактогенність вакцинного вірусу.
Перевірка антигенної активності вакцини. Антигенну активність сухого зразка вакцини вивчали на кроликах, з яких формували 3 групи по 5 голів у кожній. Вакцину вводили одноразово в дозах 2Ч105,45ТЦД50/гол. і 5Ч105,45ТЦД50/гол. внутрішньом’язово кроликам першої та другої груп відповідно. А третя група залишалась нтактним контролем.
Установлено залежність рівня продукованих вірусонейтралізуючих антитіл від дози (об’єму) щепленої вакцини. Так, у кроликів другої групи, яким вводилася вакцина в дозі 5Ч105,45 ТЦД50/гол., титр вірусоспецифічних антитіл уже на 7 добу був вищим на 1,0 log2 порівняно з показниками у тварин, щеплених вакциною в дозі 2Ч105,45ТЦД50/гол., хоча в подальшому процесі імунної відповіді титри антитіл до вакцинного вірусу діаре фактично вирівнювалися. На підставі отриманих даних зроблено висновок, що досліджуваний зразок сухої вакцини є антигенно активним.
Вивчення імуногенних властивостей вакцини живої проти вірусної діареї. Як повідомляють Сюрин В. Н. із співавт. (1983), ІРТ, ПГ–3 і ВД з характерними клінічними ознаками неможливо відтворити в експерименті в лабораторних умовах. У зв’язку з цим імуногенність, а також захисні властивості вакцинних препаратів прийнято оцінювати за їхньою антигенною активністю. На підставі зазначеного ми вивчали показники специфічного та неспецифічного імунітетів у щеплених вакциною тварин. На першому етапі цих досліджень зразки вакцини були випробувані на морських свинках, для чого було сформовано 4 групи по 10 голів у кожній. У процесі вивчення імуногенно активності вакцини, виготовленої з атенуйованого штаму ВК‑1М ВД ВРХ, на морських свинках підтверджено високу антигенність. Вакцина викликала активну індукцію специфічних вірусонейтралізуючих антитіл. У той же час вакцина у випробуваних дозах була нешкідливою для морських свинок, серед яких не спостерігали захворювання або загибелі. У морських свинок вже на 7 добу після введення вакцини в дозах 0,5 і 1,0 см3 одно- дворазово титр вірусонейтралізуючих антитіл був на рівні 4,33; 5,75 і 5,5 log2, поступово зростаючи на 14 добу до 5,45; 6,7 і 5,75 log2 відповідно. Після повторного введення вакцини спостерігали подальше зростання титрів вірусонейтралізуючих антитіл до 6,4 і 7,3 log2 відповідно, у той час як після одноразового введення їх титр фактично залишався на попередньому рівні (5,8 log2).
На підставі отриманих результатів з визначення антигенно активності сухого зразка вакцини на кроликах та вивчення імуногенної активност вакцини на морських свинках була підтверджена значущість дози і необхідність дворазового застосування вакцини живої проти ВД, що сприяло підвищенню титрів вірусонейтралізуючих антитіл. Отримані позитивні результати щодо нешкідливості та імуногенності для лабораторних тварин дозволили нам здійснити її випробування на сприйнятливих до вірусної діаре тваринах в умовах неблагополучного господарства. Враховуючи ті обставини, що вірус діареї є досить потужним імуносупресором і в організмі здатний пригнічувати імунологічну реактивність, перед тим, як застосувати вакцину живу проти ВД на ВРХ, ми випробували муномодулятор з культури Bacіllus alvei.
Вивчення імуномоделюючої активності ліпополісахариду з Bac. аlvei. Як відомо, бактеріальні ліпополісахариди є поліклональними активаторами В-системи лімфоцитів (Карпуть І. М., 1993) і суттєво стимулюють неспецифічні гуморальні та клітинні ланки імунної системи (Дранкин Г. Н. и др., 1994). А якщо взяти до уваги, що фактично більша кількість скотарських господарств є неблагополучними щодо вірусно діареї, то під час застосування живої вакцини, хоча і з атенуйованого штаму, на можливо інфікованому поголів’ї не виключаються випадки біотичної взаємодії вакцинного та епізоотичного штамів вірусу і негативний вплив утворених рекомбінацій вірусу на імунну систему щеплених тварин. З урахуванням цих обставин, а також з метою пом’якшення муносупресивної дії вірусу діареї ми використали ліпополісахарид з культури Bacіllus alvei.
Токсичність бактеріального ліпополісахариду визначали на білих мишах (по 10 голів на пробу), яким перорально вводили 0,5 см3 (162,5 мг ЛПС–1), 1 см3 (325 мг ЛПС‑1) 2 см3 (650 мг ЛПС‑1), що становило відповідно 8,125; 16,25 32,5 мг/г маси тіла миші. Під час нагляду впродовж 10 діб не було виявлено змін у загальному стані піддослідних мишей, у тому числі й контрольної групи. У груп мишей, яким підшкірно вводили 0,5 мл ЛПС–1, у місцях ін’єкцій препарату не спостерігали ні набряків, ні інших локальних змін. Отримані результати засвідчили, що виготовлений ЛПС‑1 нетоксичний як за перорального, так і підшкірного введення тваринам, у яких не встановлено клініко-фізіологічних порушень у загальному стані. Миші залишалися здоровими. На підставі цих даних було проведено дослід на кроликах з метою вивчення муномоделюючих властивостей ЛПС-1, результати якого оцінювали за трансформацією та функціональною активністю мононуклеарних попередників макрофагів, зокрема макрофагальною трансформацією мононуклеарів периферичної крові, показниками фагоцитарного індексу та фагоцитарного числа. Установлено, що ЛПС‑1 здатний підвищувати трансформативну активність попередників макрофагів, яка зростала в 1,5 рази.
Отже, результати вивчення властивостей виготовленого ЛПС‑1 свідчать про те, що він є нешкідливим для тварин, має виражені стимулюючі властивості.
З метою визначення оптимальної дози ЛПС‑1, яка б забезпечувала активізацію імунної відповіді, здійснено подальші досліди на 6 групах кроликів (по 5 голів у кожній), яким вводили внутрішньом’язово препарат у дозах 1, 2, 5, 7 і 10 мкг/кг маси тіла тварин. Нагляд за піддослідними тваринами здійснювали впродовж 14 діб. Контрольній групі вводили фізіологічний розчин.
Установлено, що ЛПС‑1 активізує ланки клітинного імунітету. Імуномодулююча дія ЛПС‑1 виявлялась уже на 7 добу в тварин усіх груп, які отримували препарат незалежно від його дози, але різною мірою щодо реакції імунокомпетентних клітин. Найбільш виражена стимулююча активність ЛПС‑1 спостерігалася у групах кроликів, які отримували 5 і 7 мкг препарату з розрахунку на кілограм маси тіла. Зокрема стабільно й достовірно підвищувалася фагоцитарна активність, де фагоцитарне число й фагоцитарний індекс зростали до 9,05–9,08 9,05–10,45 одиниць відповідно проти 4,46 (у середньому) в контролі. Ці показники стимулювання імунокомпетентних клітин були близькими до результатів дії ЛПС‑1 у дозі 10 мкг/кг маси тіла кроликів. Виходячи з цього, було визнано доцільним застосування ЛПС‑1 у дозі 7 мкг/кг маси тіла тварини.
Отже, результати визначення оптимальної дози ЛПС‑1 дозволили встановити, що цей препарат може застосовуватися з розрахунку 7 мкг/кг маси тіла для підвищення резистентності організму тварин стимуляції післявакцинального імунітету.
Вивчення імуногенност вакцини живої культуральної проти вірусної діареї на телятах. Імуногенність вакцини живої культурально з атенуйованого штаму ВК‑1М вірусу діареї вивчали на телятах у неблагополучному щодо вірусної діареї дослідному господарстві «Українка Слобідська» згідно з наказом директора ІЕКВМ УААН № 7-б від 20 січня 2004 року.
Випробування запропоновано вакцини здійснювали за методикою, що була розглянута й схвалена методичною комісією ІЕКВМ УААН (протокол № 1 від 2 лютого 2004 року), згідно з якою в господарстві було сформовано 5 груп телят 3–4-місячного віку (по 5 голів у кожній). До застосування вакцини в телят усіх дослідних груп виявлені специфічні до вірусу діареї антитіла в титрах від 3,5 до 4,5 log2 (рис. 1).
Першій групі телят вакцину щепили внутрішньом’язово дворазово з інтервалом у 14 діб у дозі 2Ч105,45 ТЦД50/гол., а другій – 5Ч105,45ТЦД50/гол., що відповідно містились у щепних об’ємах 2 і 5 см3. Телятам третьої групи вакцина в дозі 2Ч105,45 ТЦД50/гол. була введена одночасно з ЛПС-1 із розрахунку 7 мкг/кг маси тіла тварин. Телята четвертої групи отримували лише ЛПС-1 у дозі 7 мкг/кг маси тіла. П’ята група телят була контрольною, якій н вакцина, ні ліпополісахарид не щепили. Отримані дані свідчать про те, що вакцина позитивно впливала на динаміку імунної відповіді незалежно від вихідної серопозитивност телят до її застосування.
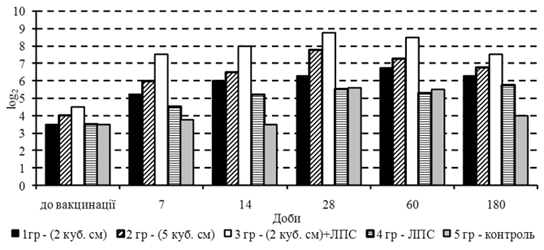
Рис. 1. Динаміка специфічних антитіл у телят, щеплених вакциною проти вірусної діареї в комплексі з ЛПС-1
Інтенсивність приросту титрів специфічних до вакцинного вірусу антитіл у телят залежала від щепної дози. Так, на 7 добу після введення вакцини в дозах 2 і 5 см3/гол. їх титр зростав на 1,75 і 2,0 log2 відповідно, а на 28 добу він був вищим на 2,8 і 3,75 log2 порівняно з вихідним (3,5 4,0 log2).
Застосування ліпополісахариду суттєво підсилювало приріст титру антитіл за одночасного щеплення вакцини в дозі 2Ч105,45ТЦД50/гол. у середньому на 2,0 log2 відносно титрів антитіл у разі застосування однієї вакцини в цій дозі. Перевагу застосування вакцини в комплексі з ЛПС-1 підтверджено також стабільним утриманням високого рівня титру специфічних антитіл упродовж 60 діб з поступовим зниженням його до 7,5±0,23 log2 на 180 добу, а також даними щодо титру нейтралізуючих антитіл у разі застосування однієї вакцини в доз 5Ч105,45 ТЦД50/гол., де він був у середньому на 1,5 log2 нижчим.
У разі щеплення вакцини в комплексі з ЛПС-1 у сироватц крові телят збільшувався вміст загального білка, імуноглобулінів класів М і G, циркулюючих мунних комплексів, що свідчить про посилення показників неспецифічної резистентності.
Важливим моментом у виборі щепної дози вакцини було дослідження концентрації серомукоїдів, підвищення рівня яких було виявлено вже на 3 добу в телят, яким щепили препарат у дозі 5Ч105,45 ТЦД50/гол., і майже в 3,5 рази на 14 добу після першого щеплення.
Підвищення рівня серомукоїдів свідчить про виражену імуносупресивну дію вакцини живої в дозі 5 см3 (5Ч105,45 ТЦД50/гол.) на клітинну ланку імунітету, що збігається з даними F. A. Roth et al. (1983, 1986) вказує на недоцільність застосування живої вакцини в такій дозі.
Отже, за результатами цього досліду встановлено, що випробувана вакцина проти вірусної діареї у разі введення телятам як окремо в дозах 2Ч105,45 ТЦД50/гол. і 5Ч105,45 ТЦД50/гол., так і в меншій дозі одночасно з ЛПС‑1 виявляє виражені імуногенні властивості. Вакцина, введена в дозі 2Ч105,45 ТЦД50/гол. (2 см3) у комплекс з ЛПС‑1, викликає індукцію вірусонейтралізуючих антитіл у середньому на 2,0 log2 вище порівняно з їх титрами, які виявляються під час застосування однієї вакцини в такій же дозі. Щеплення вакцини в комплексі з ЛПС‑1 позитивно впливає на всі ланки імунітету, в тому числі й неспецифічного. У той же час у раз застосування вакцини в дозі 5Ч105,45 ТЦД50/гол. виявляється муносупресивний ефект, що свідчить про недоцільність її введення телятам у цій дозі. Одночасне щеплення ЛПС‑1 з вакциною в дозі 2Ч105,45 ТЦД50/гол. стимулює біосинтез факторів специфічної й неспецифічної резистентності, що свідчить про імуномодулюючу дію застосовуваного ліпополісахариду.
Вивчення профілактичної ефективності вакцини живої культуральної проти вірусної діареї у виробничих умовах. Виробниче комісійне випробування профілактичної ефективності вакцини здійснено в неблагополучному щодо вірусної діаре господарстві на 72 телятах 21–28-добового та 3–4-місячного віку, з яких були сформован по 3 групи по 12 тварин у кожній. У досліді використали експериментальну серію вакцини живої культуральної проти вірусної діареї та імуномодулятор ЛПС-1, виготовлений з культури Bacіllus alvei, що були заздалегідь перевірені на стерильність та нешкідливість для тварин. Ліофілізований зразок вакцини мав інфекційність на рівні 5,45 lg ТЦД50/см3.
У процесі вивчення динаміки імунітету встановлено, що в телят як перших (21–28-добового і 3–4-місячного віку), так і других груп, котрим щепили відповідно одну вакцину в дозі 2Ч105,45 ТЦД50/гол. вакцину в цій дозі в комплексі з ЛПС‑1 із розрахунку 7 мкг/кг маси тіла тварин, вже на 7 добу було виявлено зростання титру вірусонейтралізуючих антитіл до 3,2 і 4,3 log2. Причому, титр вірусонейтралізуючих антитіл у телят 21–28-добового віку, котрим вакцину щепили в комплексі з ЛПС‑1, був вищим на 0,9 log2 порівняно з введенням однієї вакцини. Після другого введення цих препаратів титр антитіл стабілізувався на рівні 6,4–8,0 log2 і утримувався до 60 доби, після чого дещо знижувався до 5,3–7,1 log2 на 180 добу.
У процесі щоденного клінічного нагляду та термометрії телят протягом перших 14 діб не було виявлено погіршення загального стану тварин, а також підвищення температури тіла. У подальшому не встановлено хворих тварин серед щеплених як однією вакциною, так і вакциною в комплексі з ЛПС-1, у той час як у контрольних групах телята перехворіли з ознаками ураження очей (гіперемія кон’юнктиви, сльозотеча) та слизової оболонки верхніх дихальних шляхів (слизовитікання з носа, кашель), а також підвищенням на 1,0–1,5 °С температури тіла, що спостерігались упродовж 2–3 тижнів, після чого клінічні ознаки поступово згасали. Температурна реакція була нестабільною, частіше реєструвалася надвечір протягом 7–12 діб. Клінічні ознаки були більш вираженими в телят молодшого віку.
Отже, результати комісійного випробування вакцини живо культуральної проти вірусної діареї великої рогатої худоби на телятах у виробничих умовах надали підставу вважати, що вона відповідає вимогам ТУУ за відсутністю контамінац сторонніми мікроорганізмами, високою антигенною активністю та здатністю індукувати мунітет в організмі щеплених нею телят, захищає їх від проявів клінічних ознак хвороби.
За результатами комісійного виробничого випробування вакцина жива культуральна проти вірусної діареї була рекомендована для впровадження в біофабричне виробництво та застосування для профілактики вірусної діареї у неблагополучних щодо цієї хвороби господарствах.
На підставі отриманих даних ми пропонуємо спосіб профілактики вірусної діареї ВРХ у неблагополучних господарствах шляхом застосування живої вакцини з атенуйованого вірусу штаму ВК–1М і ліпополісахариду з Bacillus alvei (ЛПС–1).
За результатами здійснених досліджень розроблено нормативну документацію на вакцину живу культуральну проти вірусної діареї великої рогато худоби (інструкція з виготовлення й контролю якості, ТУУ та настанова із застосування), в подальшому розглянуту і схвалену методичною комісією ІЕКВМ УААН (протокол № 16 від 8 грудня 2004 р.) і подану на експертизу до ДНКІБШМ та узгодження до Державного департаменту ветеринарної медицини України.
ВИСНОВКИ
1. У дисертації подано експериментальне й практичне вирішення проблеми специфічної профілактики вірусно діареї великої рогатої худоби, а саме: створено живу культуральну вакцину та розроблено технологію її виготовлення. За результатами досліджень щодо вивчення тест-об’єкту для культивування вірусу діареї, його інфекційності, антигенних та імуногенних властивостей обрано клітинну систему і виробничий штам вірусу для напрацювання вихідної сировини з метою виготовлення вакцини. Створено препаративну форму вакцини живої культурально проти вірусної діареї, обґрунтовано формування й корекцію післявакцинального імунітету, запропоновано комплексне застосування вакцини та імуномодулятора з бактеріального ліпополісахариду.
2. Розроблено живу культуральну вакцину проти вірусної діареї великої рогатої худоби з модифікованого штаму ВК-1М вірусу діареї, репродукованого в ролерній моношаровій культурі перещеплюваних клітин КСТ, з інфекційністю 5,45 lg ТЦД50/см3, яку стабілізовано в процесі ліофілізації за допомогою 5,6 %‑ї сахарози і 2,8 %-го желатину (кінцев концентрації). Вакцина не контамінована сторонніми мікроорганізмами, нешкідлива для тварин, слабореактогенна, призначена для щеплення великої рогатої худоби в неблагополучних господарствах.
3. Перещеплювані культури клітин ТрТ, ВНК-21/13 та КСТ мають високу проліферативну активність у процесі вирощування в суміші з рівних об’ємів поживних середовищ 199 та Ігла і 10 % нормальної сироватки крові великої рогатої худоби. Посівна концентрація з розрахунку 300 тисяч клітин/см3 поживного середовища забезпечує відповідно в 2,6; 4,8 і 4,9 рази вищий їх приріст за ролерного способу культивування, який скорочує на 20–48 годин термін накопичення біомаси клітин для напрацювання вихідної для виготовлення вакцини вірусно сировини порівняно зі стаціонарним у матрасах.
4. Виробничий штам ВК-1М вірусу діареї, адаптований до розмноження в культурі перещеплюваних клітин у ролерних бутлях, зберігає активну репродуктивну здатність і має високу інфекційність. Оптимальний час репродукції та титр його інфекційності становить у культурі перещеплюваних клітин ТрТ відповідно 46 годин і 7,05 lg ТЦД50/см3, ВНК-21/13 64 години і 7,0 lg ТЦД50/см3. Більш придатною для репродукц та накопичення біомаси штаму ВК-1М є перещеплювана культура КСТ, яка забезпечу його репродукцію впродовж 40 годин з інфекційністю 7,6 lg ТЦД50/см3.
5. Щеплення вакцини живої культуральної проти вірусної діареї в об’ємах 2 і 5 см3, що вміщують відповідно 2Ч105,45 ТЦД50 і 5Ч105,45 ТЦД50 вакцинного вірусу, забезпечує в імунізованих телят індукцію вірусонейтралізуючих антитіл, які виявляються на 7 добу після введення препарату в титрах 5,0 і 6,0 log2 відповідно, рівень яких зростає на 28 добу після повторного введення з інтервалом у 14 діб до 6,0 і 7,7 log2, відповідно, та утримуються на цьому рівн до 60 доби, після чого на 180 добі дещо знижуються до 5,9 і 6,75 log2.
6. Обґрунтовано та практично підтверджено в експерименті залежність імуногенності виробничого штаму ВК-1М від його інфекційності в щепному об’ємі та кратності введення. Установлено, що з підвищенням дози вірусу в щепному об’ємі від 0,5Ч105,45 ТЦД50 до 1Ч105,45 ТЦД50 для морських свинок і від 2Ч105,45 ТЦД50 до 5Ч105,45ТЦД50 для телят за дворазового введення зростає індукція вірусонейтралізуючих антитіл у 1,5 рази в порівнянні з одноразовим і становить 7,3 і 8,0 log2 відповідно.
7. Вакцинний вірус (штам ВК-1М), у дозі 5Ч105,45 ТЦД50 в щепному об’ємі виявля муносупресивні властивості, про що свідчить підвищення в 3,5 рази серомукоїдів у організмі щеплених проти вірусної діареї телят. Застосування бактеріального ліпополісахариду ЛПС-1, виготовленого з культури Bacillus alvei (штам 413), із розрахунку 7 мкг/кг маси тіла телят одночасно із щепленням вакцини живої культуральної проти вірусної діареї активізує як специфічні, так і неспецифічні фактори резистентност у тварин, чинить імунореабілітуючу дію на імунну систему, згладжує імуносупресивність підвищує імунну відповідь на виробничий штам вірусу діареї з продукцією вірусонейтралізуючих антитіл на 2 log2 вище порівняно з щепленням однієї вакцини в дозі 2Ч105,45 ТЦД50/гол.
8. Запропоновано спосіб мунізації телят проти вірусної діареї в неблагополучних щодо цієї хвороби господарствах з застосуванням дворазового введення з інтервалом 14 діб внутрішньом’язово 2 см3 вакцини живої культуральної, що вміщує 2Ч105,45 ТЦД50 виробничого штаму ВК-1М вірусу діареї, одночасно з ЛПС-1 з розрахунку 7 мкг/кг маси тіла тварини, що забезпечує формування гуморального імунітету, починаючи з 7-ї доби після щеплення, захищає тварин від захворювання впродовж 180 діб (термін спостереження).
1. Вакцина жива культуральна проти вірусної діареї великої рогатої худоби та нормативна документація (інструкція з виготовлення та контролю за показниками якості вакцини живої культуральної проти вірусної діареї великої рогатої худоби, ТУУ на вакцину живу культуральну проти вірусної діареї великої рогатої худоби та листівка-вкладка із застосування вакцини живої культуральної проти вірусної діаре великої рогатої худоби), що розглянута й схвалена на засіданні методичної коміс ІЕКВМ УААН (протокол № 16 від 8 грудня 2004 р.). Досьє на вакцину подано на експертизу до ДНКІБШМ та узгодження до Державного комітету ветеринарної медицини України.
2. Спосіб профілактики вірусної діареї великої рогато худоби, що передбачає одночасне застосування вакцини живої культуральної проти вірусно діареї та імуностимулюючого ліпополісахариду ЛПС-1, виготовленого з Bacillus alvei.
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Стеценко, В.І. Антигенна спорідненість та відмінність різних штамів вірусу діареї великої рогатої худоби [Текст] / В. І. Стеценко, О. В. Годовський, Л. І. Кучерявенко, Л.П. Тризна, Ю. С. Голуб, І.В. Чебанюк // Вет. медицина : міжвід. темат. наук. зб. — Х, 2002. — Вип. 80. — С. 589–594. (Дисертанткою проведено накопичення клітинної біомаси перещеплюваних клітин ПТ, ТрТ, КСТ, 9‑разов пасажі трьох штамів вірусу діареї в цих культурах клітин, визначення їх інфекційност та антигенної спорідненості).
2. Стеценко, В. І. Вивчення реактогенних та антигенних властивостей різних штамів вірусу діареї великої рогатої худоби [Текст] / В. І. Стеценко, Л. П. Тризна, І.В. Чебанюк, Л. Н. Покусай // Вет. медицина : міжвід. темат. наук. зб. Х., 2003. — Вип. 81. — С. 351–356. (Дисертанткою проведено накопичення вірусовміщуючо культуральної суспензії трьох штамів ВД і вивчено в біопробі на кроликах їх реактогенність з оцінкою стану клітинного імунітету).
3. Чебанюк, І.В. Корекція імунітету ліпополісахаридом Bacіllus alvei при застосуванні живої вакцини проти вірусної діареї великої рогатої худоби [Текст] / І.В. Чебанюк, В.І. Стеценко, Л.П. Тризна // Вет. медицина : міжвід. темат. наук. зб. — Х., 2004. — Вип. 83. — С. 258–262. (Дисертанткою вивчались властивост ліпополісахаридного імуностимулятора та дослідних зразків вакцини проти ВД ВРХ).
4. Коваленко, Л. В. Динамика гуморального иммунитета телят, привитых живой вакциной против вирусной диареи крупного рогатого скота [Текст] / Л. В. Коваленко, И. В. Чебанюк, С. А. Михайлова, М. Е. Романько, В. С. Бойко // Вет. медицина : міжвід. темат. наук. зб. — Х., 2004. — Вип. 84. — С. 341–345. (Дисертанткою проведено щеплення тварин та дослідження сироваток крові в реакції нейтралізац на наявність антитіл до вірусу діареї, здійснено аналіз стану гуморального імунітету).
5. Чебанюк, І. В. Випробування вакцини живої проти вірусної діаре великої рогатої худоби [Текст] / І. В. Чебанюк // Вет. медицина : міжвід. темат. наук. зб. — Х., 2005. — Вип. 85. — Т. 2. — С. 1110–1113.
6. Деклараційний патент на корисну модель № 5153 Україна мпк7 А61К39/12. Спосіб профілактики вірусної діареї великої рогатої худоби [Текст] / Стеценко В. І., Кучерявенко Л. І., Чебанюк І. В., Тризна Л. П. ; заявник і патентовласник Інститут експериментальної і клінічної ветеринарної медицини. — № 20040705657 ; заявл. 12.07.04 ; опубл. 15.02.05, Бюл. № 2. — 4 с.
АНОТАЦІЇ
Малакєєва-Чебанюк Ірина Владиславівна. Розробка живої культуральної вакцини проти вірусної діареї великої рогатої худоби. Рукопис.
Дисертація на здобуття наукового ступеня кандидата ветеринарних наук за спеціальністю 16.00.03 – ветеринарна мікробіологія та вірусологія. Національний науковий центр «Інститут експериментальної і клінічно ветеринарної медицини». Харків, 2008.
Захищаються матеріали, які містять результати експериментальних досліджень із розробки технології виготовлення на основі модифікованого штаму ВК-1М вірусу діареї вакцини живої культуральної проти вірусної діареї та вивчення її імуногенно ефективності в лабораторних і виробничих умовах.
Випробувана культура клітин КСТ, що має високу продуктивну здатність щодо формування моно шару під час ролерного культивування, забезпечу активну репродукцію вірусу та накопичення його вихідної біомаси для виготовлення вакцини.
У лабораторних умовах на білих мишах, морських свинках, кроликах та на телятах у неблагополучних щодо вірусної діареї великої рогатої худоби господарствах вивчено антигенні властивості вакцини та імуногенність зразків рідко й сухої живої вакцини проти вірусної діареї.
Показано, що атенуйований штам вірусу діареї, репродукований у культурі перещеплюваних клітин КСТ із кінцевим титром інфекційності 7,6 lg ТЦД50/см3, активно індукує в організмі щеплених тварин вірусонейтралізуючі антитіла.
Запропонована технологія культивування клітин та вірусу дозволяє одержувати неконтаміновану сторонньою мікрофлорою (бактеріями, грибами, вірусами), нешкідливу для тварин та високоімуногенну вакцину. У дозі 2Ч105,45 ТЦД50/гол. за одночасного введення з бактеріальним ліпополісахаридом з розрахунку 7 мкг/кг маси тіла тварин дворазово з інтервалом 14 діб вона активізу в організмі щеплених тварин усі ланки імунної системи, забезпечуючи індукцію вірусонейтралізуючих антитіл у титрах до 8,0 log2 і захист від захворювання на вірусну діарею.
Розроблено проект нормативної документації на вакцину живу культуральну проти вірусної діареї великої рогатої худоби, який надіслано для експертизи до ДНКІБШМ та узгодження в Державному комітеті ветеринарної медицини України.
Ключові слова: вірусна діарея, велика рогата худоба, виробничий штам вірусу, культура клітин, антигенні властивості, вакцина, муномодулятор, специфічна профілактика.
Малакеева-Чебанюк Ирина Владиславовна. Разработка живой культуральной вакцины против вирусной диареи крупного рогатого скота. – Рукопись.
Диссертация на соискание учёной степени кандидата ветеринарных наук по специальности 16.00.03 – ветеринарная микробиология и вирусология. Национальный научный центр «Институт экспериментальной и клинической ветеринарной медицины». Харьков, 2008.
Диссертация посвящена разработке вакцины и способа специфической профилактики вирусной диареи телят в неблагополучных по данной вирусной инфекции хозяйствах, основанного на принципе одновременного введения живой вакцины и иммуностимулирующего бактериального липополисахарида ЛПС–1 из Bacillus alvei.
Защищаются материалы, которые включают результаты экспериментальных исследований по разработке технологии изготовления вакцины живой культуральной против вирусной диареи крупного рогатого скота и изучения её имуногенной эффективности в лабораторных и производственных условиях.
Подобрана культура клеток, обладающая высокой продуктивной способностью к формированию монослоя при роллерном культивировании, которая обеспечивает активную репродукцию вируса и накопление его исходной биомассы для изготовления вакцины.
В лабораторных условиях на белых мышах, морских свинках, кроликах и на телятах в неблагополучных по вирусной диарее крупного рогатого скота хозяйствах испытаны антигенные свойства и имуногенность образцов жидкой и сухой вакцины против вирусной диареи.
Показано, что аттенуированный штамм вируса диареи, репродуцированный в культуре перевиваемых клеток КСТ с конечным титром инфекционности 7,6 lg ТЦД50/мл, активно индуцирует в организме привитых животных вируснейтрализующие антитела.
Предложенная технология культивирования клеток и вируса позволяет получать не контаминированную посторонней микрофлорой (бактериями, микоплазмами, грибами, вирусами), безвредную для животных и высокоиммуногенную вакцину. В дозе 2Ч105,45 ТЦД50/гол. при одновременном введении с липополисахаридом бактериального происхождения из расчёта 7 мкг/кг массы тела животного двукратно с интервалом 14 суток она активизирует в организме вакцинированных животных индукцию вируснейтрализующих антител в титрах до 8,0 log2 и защищает от заболевания вирусной диареей.
Применение бактериального липополисахарида ЛПС-1, полученного из культуры Bacillus alvei (штамм 413), из расчёта 7 мкг/кг массы тела телят одновременно с введением вакцины живой культуральной против вирусной диареи активизирует как специфические, так и неспецифические факторы резистентности у животных, проявляет иммунореабилитирующее действие на иммунную систему, сглаживает имуносупрессивность и повышает иммунный ответ на введение производственного штамма вируса диареи.
Разработан проект нормативной документации на вакцину живую культуральную против вирусной диареи крупного рогатого скота, который направлен на экспертизу в Государственный научно-контрольный институт биотехнологии и штаммов микроорганизмов и для согласования в Государственном комитете ветеринарной медицины Украины.
Ключевые слова: вирусная диарея, крупный рогатый скот, производственный штамм вируса, культура клеток, антигенные свойства, вакцина, иммунитет, иммуномодулятор, специфическая профилактика.
Malakeyeva–Chebanyuk Irina Vladislavovna. Development of an alive cultural vaccine against virus diarrhea of cattle.- Manuscript.
Dissertation presented for obtaining the scientific degree of a candidate of veterinary
sciences in speciality 16.00.03 – veterinary microbiology and virology. National scientific center «Institute of experimental and clinical veterinary medicine». Kharkiv, 2008.
Materials are defended that contain the experimental research results of alive cultural against virus diarrhea vaccine’s making technology development on the basis of a modified strain of BK-1M virus diarrhea and its immunogenic efficiency in laboratory and production conditions.
A calf coroner vessels cell culture is chosen that has a high productive ability in relation to forming a monolayer at roller cultivation, provides an active virus reproduction and accumulation of the virus output biomass for vaccine making.
Antigen vaccine’s properties and immunogenity of liquid and dry alive against virus diarrhea vaccine’s samples are studied in laboratory conditions on white mice, guinea-pigs, rabbits, and calves at the farms unfortunate in relation to virus diarrhea of cattle.
It is shown that attenuated virus diarrhea strain reproduced in the culture of revaccinated calf coronary vessels’ cells with the final infectiousness title of 7,6 lg ТCID 50/см3, actively induces virus neutralizing antibodies in the organisms of the vaccinated animals.
Proposed cells and virus cultivation technology allows to obtain non-contaminated with extraneous microflora (by bacteria, candida, viruses), harmless for animals and highly immunogenic vaccine. In a dose 2Ч105,45 ТCID 50/animal with a simultaneous injection with bacterial lipopolysaccharide from the calculation of 7 mkg/kg of animal mass, twice with a fortnight interval, it activates all links of the immune system in the organism of the vaccinated animals, providing induction of virus neutralizing antibodies in titles to 8,0 log2 and defense against virus diarrhea.
The developed project of normative documents on a vaccine alive cultural against virus diarrhea of cattle is sent for examination of The State Scientific Control Institute of Biotechnology and Strains of Microorganisms and coordination at the State Department of Veterinary Medicine of Ukraine.
Keywords: virus diarrhea, cattle, production virus strain, cell culture, antigen properties, vaccine, immunomodulator, specific prevention.
© 2009 База Рефератов